题目内容
13.甲、乙都是二元固体化合物,将32g甲的粉末加入足量浓硝酸并加热,完全溶解得蓝色溶液,向该溶液中加入足量Ba(NO3)2溶液,过滤、洗涤、干燥得沉淀46.6g;滤液中再滴加NaOH溶液,又出现蓝色沉淀.含乙的矿石自然界中储量较多,称取一定量乙,加入稀盐酸使其全部溶解,溶液分为A、B两等份,向A中加入足量氢氧化钠溶液,过滤、洗涤、灼烧得红棕色固体28g,经分析乙与红棕色固体的组成元素相同,向B中加入8.0g铜粉充分反应后过滤、洗涤、干燥得剩余固体1.6g.
(1)写出构成甲的阴离子的结构示意图
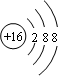 ;32g甲在足量浓硝酸中反应转移的电子数为2NA;甲在足量氧气中充分灼烧的化学方程式为Cu2S+2O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2.
;32g甲在足量浓硝酸中反应转移的电子数为2NA;甲在足量氧气中充分灼烧的化学方程式为Cu2S+2O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2.(2)乙的化学式Fe7O9;稀硫酸溶解乙的化学方程式为9H2SO4+Fe7O9=3FeSO4+2Fe2(SO4)3+9H2O.
分析 将32g甲的粉末加入足量浓硝酸并加热,完全溶解得蓝色溶液,向该溶液中加入足量Ba(NO3)2溶液,过滤、洗涤、干燥得沉淀46.6g,该沉淀为硫酸钡,其物质的量为:$\frac{46.6g}{233g/mol}$=0.2mol,根据质量守恒可知甲中含有0.2molS原子;滤液中再滴加NaOH溶液,又出现蓝色沉淀,该蓝色沉淀为氢氧化铜,说明甲中含有Cu离子,32g甲中含有铜元素的物质的量为:$\frac{32g-32g/mol×0.2mol}{64g/mol}$=0.4mol,则甲的化学式为:Cu2S;
含乙的矿石自然界中储量较多,称取一定量乙,加入稀盐酸使其全部溶解,溶液分为A、B两等份,向A中加入足量氢氧化钠溶液,过滤、洗涤、灼烧得红棕色固体28g,该红棕色固体为Fe2O3,氧化铁含有铁元素的物质的量为:$\frac{28g}{160g/mol}$×2=0.35mol,可能为铁离子和亚铁离子的混合物;经分析乙与红棕色固体的组成元素相同,则乙中含有Fe、O元素;向B中加入8.0g铜粉充分反应后过滤、洗涤、干燥得剩余固体1.6g,反应消耗铜的物质的量为:$\frac{8g-1.6g}{64g/mol}$=0.1mol,根据反应2Fe3++Cu═2Fe2++Cu2+可知,0.1mol铜完全反应消耗0.2molFe3+;所以乙与盐酸反应生成的为0.2molFe3+、0.15molFe2+,铁的平均化合价为:$\frac{0.2mol×3+0.15mol×2}{0.35mol}$=$\frac{18}{7}$,则乙的化学式为:Fe7O9,据此进行解答.
解答 解:将32g甲的粉末加入足量浓硝酸并加热,完全溶解得蓝色溶液,向该溶液中加入足量Ba(NO3)2溶液,过滤、洗涤、干燥得沉淀46.6g,该沉淀为硫酸钡,其物质的量为:$\frac{46.6g}{233g/mol}$=0.2mol,根据质量守恒可知甲中含有0.2molS原子;滤液中再滴加NaOH溶液,又出现蓝色沉淀,该蓝色沉淀为氢氧化铜,说明甲中含有Cu离子,32g甲中含有铜元素的物质的量为:$\frac{32g-32g/mol×0.2mol}{64g/mol}$=0.4mol,则甲的化学式为:Cu2S;
含乙的矿石自然界中储量较多,称取一定量乙,加入稀盐酸使其全部溶解,溶液分为A、B两等份,向A中加入足量氢氧化钠溶液,过滤、洗涤、灼烧得红棕色固体28g,该红棕色固体为Fe2O3,氧化铁含有铁元素的物质的量为:$\frac{28g}{160g/mol}$×2=0.35mol,可能为铁离子和亚铁离子的混合物;经分析乙与红棕色固体的组成元素相同,则乙中含有Fe、O元素;向B中加入8.0g铜粉充分反应后过滤、洗涤、干燥得剩余固体1.6g,反应消耗铜的物质的量为:$\frac{8g-1.6g}{64g/mol}$=0.1mol,根据反应2Fe3++Cu═2Fe2++Cu2+可知,0.1mol铜完全反应消耗0.2molFe3+;所以乙与盐酸反应生成的为0.2molFe3+、0.15molFe2+,铁的平均化合价为:$\frac{0.2mol×3+0.15mol×2}{0.35mol}$=$\frac{18}{7}$,则乙的化学式为:Fe7O9,
(1)甲为Cu2S,甲中阴离子为硫离子,硫离子结构示意图为: ;32gCu2S的物质的量为:$\frac{32g}{160g/mol}$=0.2mol,浓硝酸足量,Cu元素从+1转化成+2价、硫元素从-2转化成+6价,则反应中失去电子总物质的量为:0.2mol×2×(2-1)+0.2mol×[6-(-2)]=2mol,反应转移电子总数为2NA;甲在足量空气中灼烧生成氧化铜、二氧化硫气体,反应的化学方程式为:Cu2S+2O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2,
;32gCu2S的物质的量为:$\frac{32g}{160g/mol}$=0.2mol,浓硝酸足量,Cu元素从+1转化成+2价、硫元素从-2转化成+6价,则反应中失去电子总物质的量为:0.2mol×2×(2-1)+0.2mol×[6-(-2)]=2mol,反应转移电子总数为2NA;甲在足量空气中灼烧生成氧化铜、二氧化硫气体,反应的化学方程式为:Cu2S+2O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2,
故答案为: ;2NA;Cu2S+2O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2;
;2NA;Cu2S+2O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2;
(2)根据分析可知,乙的化学式为:Fe7O9;稀硫酸与乙反应的化学方程式为:9H2SO4+Fe7O9=3FeSO4+2Fe2(SO4)3+9H2O,
故答案为:Fe7O9;9H2SO4+Fe7O9=3FeSO4+2Fe2(SO4)3+9H2O.
点评 本题考查了性质实验方案的设计、混合物反应的计算,题目难度中等,正确推断甲和乙的化学式为解答关键,注意掌握常见反应化学方程式的书写原则,明确性质实验方案设计的方法,试题培养了学生的分析能力及化学实验能力.

 名校课堂系列答案
名校课堂系列答案| A. | Pb为正极,发生氧化反应 | B. | SO42-只向正极移动 | ||
| C. | 电解质溶液密度不断减小 | D. | 溶液的pH不断减小 |
| A. | M一定是强电解质 | B. | M一定是弱电解质 | C. | M一定是某种盐 | D. | M一定是某种强碱 |
| A. | 发生氧化反应的是H2C2O4 | |
| B. | 离子方程式右侧方框内的产物是H2O | |
| C. | 每消耗6 mol H+,转移5 mol电子 | |
| D. | 还原性:Mn2+<H2C2O4 |
| A. | x=2.25 y=4.74% | B. | x=5 y=11.11% | ||
| C. | x=5 y=10% | D. | x=2.875 y=5.75% |
| A. | 用废弃动植物油脂与低碳醇通过酯交换反应制成生物柴油来代替柴油作为机车燃料,这种做法符合“绿色化学”理念 | |
| B. | 生物炼铜是利用生物质能转化为化学能的原理实现的 | |
| C. | 元素分析仪不但可以检测物质中的许多非金属元素,也可以检测金属元素 | |
| D. | 霾是悬浮在大气中的大量微小尘粒、烟粒或盐粒的集合体,霾的形成与PM2.5有直接关系 |
| A. | 加热 | B. | 加HCl | C. | 加NaOH | D. | 加AlCl3 |
 .
.