题目内容
3.铅蓄电池的两极分别为Pb、PbO2,电解质溶液为H2SO4,工作时反应为Pb+PbO2+2H2SO4?2PbSO4+2H2O,下列结论正确的是( )| A. | Pb为正极,发生氧化反应 | B. | SO42-只向正极移动 | ||
| C. | 电解质溶液密度不断减小 | D. | 溶液的pH不断减小 |
分析 由铅蓄电池的总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O可知,放电时,Pb被氧化,应为电池负极反应,
电极反应式为Pb-2e-+SO42-=PbSO4,正极上PbO2得电子被还原,电极反应式为PbO2+SO42-+2e-+4H+═PbSO4+2H2O,原电池中阳离子向正极移动,阴离子向负极移动.
解答 解:A.由铅蓄电池的总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O可知,Pb为负极,发生失电子的氧化反应,被氧化,故A错误;
B、原电池中阳离子向正极移动,阴离子硫酸根向负极Pb极移动,故B错误;
C、由铅蓄电池的总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O可知,硫酸被消耗,所以酸性减弱,所以电解质溶液密度不断减小,故C正确;
D、由铅蓄电池的总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O可知,硫酸被消耗,pH不断增大,故D错误.
故选C.
点评 本题考查了原电池原理,侧重于学生的分析能力的考查,注意根据元素化合价变化确定正负极,再结合阴阳离子的移动方向、氢离子浓度的变化来分析解答,难度中等.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
13.能正确表示下列反应的离子方程式的是( )
| A. | 将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| C. | 碳酸氢铵溶液中加入过量的氢氧化钠溶液:HCO3-+OH-═CO32-+H2O | |
| D. | 碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
8.一定温度下在一容积不变的密闭容器中发生可逆反应2X(g)═Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
| A. | v正(X)=2v正(Y) | |
| B. | 单位时间内生成1 mol Y的同时生成2molX | |
| C. | 混合气体的密度不再变化 | |
| D. | 反应容器中Y的质量分数不变 |
15.进行过滤操作时,必须使用的玻璃仪器是( )
| A. | 试管 | B. | 烧瓶 | C. | 烧杯 | D. | 酒精灯 |
12.如图是三种有机物的结构简式
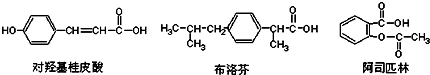
下列说法正确的是( )

下列说法正确的是( )
| A. | 三种有机物都能发生水解反应 | |
| B. | 三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种 | |
| C. | 三种物质中,其中有两种互为同分异构体 | |
| D. | 三种物质在一定条件下,均可以被氧化反应 |
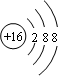 ;32g甲在足量浓硝酸中反应转移的电子数为2NA;甲在足量氧气中充分灼烧的化学方程式为Cu2S+2O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2.
;32g甲在足量浓硝酸中反应转移的电子数为2NA;甲在足量氧气中充分灼烧的化学方程式为Cu2S+2O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2.