题目内容
关于如图所示的原电池,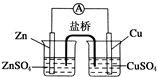 下列说法正确的是( )
下列说法正确的是( )
 下列说法正确的是( )
下列说法正确的是( )| A、盐桥中的阴离子向硫酸铜溶液中迁移 |
| B、锌电极发生还原反应,铜电极发生氧化反应 |
| C、铜电极上发生的电极反应是2H++e-→H2↑ |
| D、电子从锌电极通过检流计流向铜电极 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:该原电池中,Zn易失电子作负极、Cu作正极,正极电极反应式为Cu2++2e-=Cu,负极电极反应式为Zn-2e-=Zn2+,电子从负极沿导线流向正极,盐桥中阳离子向正极移动、阴离子向负极移动,据此分析解答.
解答:
解:A.Zn易失电子作负极、Cu作正极,阴离子向负极移动,则盐桥中阴离子向硫酸锌溶液迁移,故A错误;
B.锌失电子发生氧化反应,铜电极上铜离子得电子发生还原反应,故B错误;
C.铜电极上铜离子得电子发生还原反应,电极反应式为Cu2++2e-=Cu,故C错误;
D.锌作负极、铜作正极,电子从锌电极通过电流计流向铜电极,故D正确;
故选D.
B.锌失电子发生氧化反应,铜电极上铜离子得电子发生还原反应,故B错误;
C.铜电极上铜离子得电子发生还原反应,电极反应式为Cu2++2e-=Cu,故C错误;
D.锌作负极、铜作正极,电子从锌电极通过电流计流向铜电极,故D正确;
故选D.
点评:本题考查了原电池原理,明确正负极上发生的反应、电子及离子移动方向即可解答,题目难不大.

练习册系列答案
相关题目
目前,世界上生产的镁有60%来自海水.海水提镁,最基本的方法就是往海水里加碱使镁沉淀出来,然后经过一系列处理,最终得到单质镁.试判断:在海水提镁的过程中,不可能发生的反应有( )
A、2MgO
| ||||
B、MgCl2
| ||||
| C、Mg(OH)2+2HCl═MgCl2+2H2O | ||||
| D、Mg2++2OH-═Mg(OH)2↓ |
下列性质比较不正确的是( )
| A、离子半径:Al3+<Mg2+<F- |
| B、酸性:H2SiO3<H3PO4<H2SO4<HClO4 |
| C、热稳定性:HI>HBr>HCl>HF |
| D、碱性:NaOH>Mg(OH)2>Al(OH)3 |
在不同条件下,分别测得反应2SO2+O2?2SO3的速率如下,其中最快的是( )
| A、v(SO3)=4 mol?L-1?min-1 |
| B、v(O2)=2 mol?L-1?min-1 |
| C、v(SO2)=5 mol?L-1?min-1 |
| D、v(SO2)=0.1 mol?L-1?S-1 |
设NA为阿伏加德罗常数的数值,下列叙述正确的是( )
| A、1molCl2参加反应转移电子数一定为2NA |
| B、1L0.1mol?L-1氨水含有0.1 NA个OH- |
| C、10LpH=1的硫酸溶液中含有的H+离子数为NA |
| D、常温常温下,2.24L丁烷分子所含的C-H键数为NA |