题目内容
碱性锌锰电池是一次电池,铅蓄电池是二次电池. (判断对错)
考点:原电池和电解池的工作原理
专题:电化学专题
分析:碱性锌锰电池不能多次重复使用,铅蓄电池能多次重复使用.
解答:
解:碱性锌锰电池不能多次重复使用,属于一次电池;铅蓄电池能多次重复使用,属于二次电池,则题中说法正确;
故答案为:对.
故答案为:对.
点评:本题考查了电池的分类,题目难度不大,注意把握常见的电池,属于基础知识的考查.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案
相关题目
常温条件下,将SO2气体通入一定量NaOH溶液中,所得溶液呈中性,关于该溶液的判断错误的是( )
| A、该溶液中溶质一定为NaHSO3与Na2SO3 | ||||
B、溶液中c(Na+)=c(S
| ||||
| C、溶液中离子浓度最大的是Na+ | ||||
| D、向该溶液中加入氯化钾固体,溶液依然呈中性,且有c(K+)=c(Cl-) |
关于如图所示的原电池,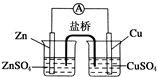 下列说法正确的是( )
下列说法正确的是( )
 下列说法正确的是( )
下列说法正确的是( )| A、盐桥中的阴离子向硫酸铜溶液中迁移 |
| B、锌电极发生还原反应,铜电极发生氧化反应 |
| C、铜电极上发生的电极反应是2H++e-→H2↑ |
| D、电子从锌电极通过检流计流向铜电极 |
下列说法中,正确的是( )
| A、铜锌原电池中,电子由锌极经导线流向铜极 |
| B、铜锌原电池中,锌作阳极,铜作阴极 |
| C、石墨电极电解氯化铜溶液的反应中,阳极上质量增重 |
| D、石墨电极电解氯化钠溶液的反应中,用氢氧化钠溶液吸收阴极产物 |
已知反应A2+B2=2AB,断开1molA2中的化学键消耗的能量为Q1 kJ,断开1molB2中的化学键消耗的能量为Q2kJ,生成1molAB中的化学键释放的能量为Q3kJ,则下列说法正确的是( )
| A、若A2和B2的总能量之和大于生成的2AB的总能量,则反应放热 |
| B、若A2和B2的总能量之和小于生成的2AB的总能量,则反应放热 |
| C、若该反应为放热反应,则Q1+Q2>Q3 |
| D、若该反应为吸热反应,则Q1+Q2<Q3 |
氮化硅是一种超硬、耐磨、耐高温的物质.下列物质熔化与氮化硅熔化所克服的微粒间作用力相同的是( )
| A、石墨 | B、氯化钠 | C、干冰 | D、水晶 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、c(Al3+)=0.1mol/L的溶液中:Na+、K+、[Al(OH)4]-、SO42- |
| B、使酚酞呈红色的溶液中:K+、Ba2+、I-、NO3- |
| C、由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、HCO3-、Cl-、Br- |
| D、加入Al能放出H2的溶液中:Cl-、SO42-、NO3-、Mg2+ |
