题目内容
实验室需1L含0.5mol NaCl、0.16mol KCl和0.24mol K2SO4的混合溶液,但实验室里只有NaCl、KCl、Na2SO4三种试剂,若配制1L溶液,需称取NaCl g,KCl g,Na2SO4 g.
考点:物质的量的相关计算
专题:计算题
分析:根据硫酸根守恒计算n(Na2SO4),再根据钠离子守恒计算n(NaCl),根据氯离子守恒计算n(KCl),根据m=nM计算各自质量.
解答:
解:原混合溶液中钠离子为0.5mol、氯离子为0.66mol、钾离子为0.64mol、硫酸根为0.24mol,
根据硫酸根守恒:n(Na2SO4)=n(K2SO4)=0.24mol,则m(Na2SO4)=0.24mol×142g/mol=34.08g;
根据钠离子守恒,n(NaCl)=0.5mol-2n(Na2SO4)=0.5mol-0.48mol=0.02mol,则m(NaCl)=0.02mol×58.5g/mol=1.17g;
根据氯离子守恒,n(KCl)=0.66mol-0.02mol=0.64mol,故m(KCl)=0.64mol×74.5g/mol=47.68g,
故答案为:1.17;47.68;34.08.
根据硫酸根守恒:n(Na2SO4)=n(K2SO4)=0.24mol,则m(Na2SO4)=0.24mol×142g/mol=34.08g;
根据钠离子守恒,n(NaCl)=0.5mol-2n(Na2SO4)=0.5mol-0.48mol=0.02mol,则m(NaCl)=0.02mol×58.5g/mol=1.17g;
根据氯离子守恒,n(KCl)=0.66mol-0.02mol=0.64mol,故m(KCl)=0.64mol×74.5g/mol=47.68g,
故答案为:1.17;47.68;34.08.
点评:本题考查物质的量有关计算,难度不大,注意利用守恒计算解答.

练习册系列答案
相关题目
下列说法正确的是( )
| A、电离时能生成H+的化合物是酸 |
| B、水溶液显碱性的物质是碱 |
| C、电解质电离时产生的阴离子全部是OH-的化合物是碱 |
| D、能与碱发生反应生成水的化合物是酸 |
关于如图所示的原电池,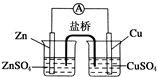 下列说法正确的是( )
下列说法正确的是( )
 下列说法正确的是( )
下列说法正确的是( )| A、盐桥中的阴离子向硫酸铜溶液中迁移 |
| B、锌电极发生还原反应,铜电极发生氧化反应 |
| C、铜电极上发生的电极反应是2H++e-→H2↑ |
| D、电子从锌电极通过检流计流向铜电极 |
已知反应A2+B2=2AB,断开1molA2中的化学键消耗的能量为Q1 kJ,断开1molB2中的化学键消耗的能量为Q2kJ,生成1molAB中的化学键释放的能量为Q3kJ,则下列说法正确的是( )
| A、若A2和B2的总能量之和大于生成的2AB的总能量,则反应放热 |
| B、若A2和B2的总能量之和小于生成的2AB的总能量,则反应放热 |
| C、若该反应为放热反应,则Q1+Q2>Q3 |
| D、若该反应为吸热反应,则Q1+Q2<Q3 |
下表给出几种氯化物的熔点和沸点(*表示在2.5×1.01×105 Pa下测定):
下列有关叙述,不正确的是( )
| NaCl | MgCl2 | AlCl3 | SiCl4 | |
| 熔点(℃) | 801 | 714 | 190* | -68 |
| 沸点(℃) | 1465 | 1418 | 180 | 57 |
| A、AlCl3在加热时升华 |
| B、SiCl4晶体属于分子晶体 |
| C、1500℃时NaCl存在气态分子 |
| D、AlCl3晶体是典型的离子晶体 |
氮化硅是一种超硬、耐磨、耐高温的物质.下列物质熔化与氮化硅熔化所克服的微粒间作用力相同的是( )
| A、石墨 | B、氯化钠 | C、干冰 | D、水晶 |
下列关于Na和Na+的叙述中正确的是( )
| A、它们相差一个电子层 |
| B、它们都能与水反应 |
| C、钠原子、钠离子均为同一元素,因此是同种微粒 |
| D、灼烧时,它们的焰色反应都呈紫色 |