题目内容
下列性质比较不正确的是( )
| A、离子半径:Al3+<Mg2+<F- |
| B、酸性:H2SiO3<H3PO4<H2SO4<HClO4 |
| C、热稳定性:HI>HBr>HCl>HF |
| D、碱性:NaOH>Mg(OH)2>Al(OH)3 |
考点:元素周期律的作用
专题:元素周期律与元素周期表专题
分析:A.电子层数相同,核电荷数越大,离子半径越小;
B.元素的非金属性越强,最高氧化物对应水化物的酸性越强;
C.元素的非金属性越强,气体氢化物的稳定性越强;
D.元素的金属性越强,最高氧化物对应水化物的碱性越强.
B.元素的非金属性越强,最高氧化物对应水化物的酸性越强;
C.元素的非金属性越强,气体氢化物的稳定性越强;
D.元素的金属性越强,最高氧化物对应水化物的碱性越强.
解答:
解:A.电子层数相同,核电荷数越大,离子半径越小,核电荷数:Al3+>Mg2+>F-,故离子半径:Al3+<Mg2+<F-,故A正确;
B.元素的非金属性越强,最高氧化物对应水化物的酸性越强,非金属性:Si<P<S<Cl,故酸性:H2SiO3<H3PO4<H2SO4<HClO4,故B正确;
C.元素的非金属性越强,气体氢化物的稳定性越强,非金属性:I<Br<Cl<F,故热稳定性:HI<HBr<HCl<HF,故C错误;
D.元素的金属性越强,最高氧化物对应水化物的碱性越强,金属性:Al<Mg<Na,故碱性:NaOH>Mg(OH)2>Al(OH)3,故D正确;
故选C.
B.元素的非金属性越强,最高氧化物对应水化物的酸性越强,非金属性:Si<P<S<Cl,故酸性:H2SiO3<H3PO4<H2SO4<HClO4,故B正确;
C.元素的非金属性越强,气体氢化物的稳定性越强,非金属性:I<Br<Cl<F,故热稳定性:HI<HBr<HCl<HF,故C错误;
D.元素的金属性越强,最高氧化物对应水化物的碱性越强,金属性:Al<Mg<Na,故碱性:NaOH>Mg(OH)2>Al(OH)3,故D正确;
故选C.
点评:本题考查学生离子半径大小的比较、元素周期律的应用,难度不大.要注意基础知识的积累.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
关于有机物 的叙述错误的是( )
的叙述错误的是( )
 的叙述错误的是( )
的叙述错误的是( )| A、分子式为C6H8O |
| B、含有羟基 |
| C、含有甲基 |
| D、含有苯环结构 |
下列说法正确的是( )
| A、电离时能生成H+的化合物是酸 |
| B、水溶液显碱性的物质是碱 |
| C、电解质电离时产生的阴离子全部是OH-的化合物是碱 |
| D、能与碱发生反应生成水的化合物是酸 |
汽车尾气的无害化处理已成为当今汽车工业的一项重要课题,其基本原理是实现2NO(g)+2CO(g)?N2(g)+2CO2(g)的反应.关于该反应,下列说法正确的是( )
| A、只要使用合理的催化剂及载体,就可完全清除NO和CO |
| B、该反应达到平衡时v(NO)正=v(CO)逆 |
| C、假设该反应在密闭容器中进行,一段时间后达到平衡时c(NO)=c(CO) |
| D、使用性能好的催化剂可使反应的平衡常数增大 |
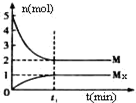 E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:xM(g)?Mx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )
E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:xM(g)?Mx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )| A、该反应的化学方程式是2HF?(HF)2 | ||
B、t1时刻,保持温度不变,再充入1molM,重新达到平衡时,
| ||
| C、平衡时混合气体的平均摩尔质量是33.3 | ||
| D、M的沸点比同主族下一周期元素的气态氢化物沸点低 |
关于如图所示的原电池,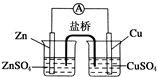 下列说法正确的是( )
下列说法正确的是( )
 下列说法正确的是( )
下列说法正确的是( )| A、盐桥中的阴离子向硫酸铜溶液中迁移 |
| B、锌电极发生还原反应,铜电极发生氧化反应 |
| C、铜电极上发生的电极反应是2H++e-→H2↑ |
| D、电子从锌电极通过检流计流向铜电极 |
下列关于Na和Na+的叙述中正确的是( )
| A、它们相差一个电子层 |
| B、它们都能与水反应 |
| C、钠原子、钠离子均为同一元素,因此是同种微粒 |
| D、灼烧时,它们的焰色反应都呈紫色 |