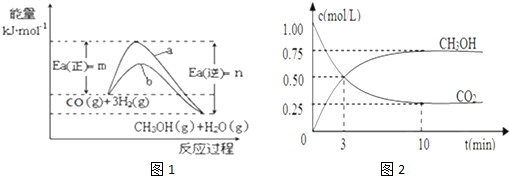
题目内容
在不同条件下,分别测得反应2SO2+O2?2SO3的速率如下,其中最快的是( )
| A、v(SO3)=4 mol?L-1?min-1 |
| B、v(O2)=2 mol?L-1?min-1 |
| C、v(SO2)=5 mol?L-1?min-1 |
| D、v(SO2)=0.1 mol?L-1?S-1 |
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:根据化学反应速率之比等化学计量数之比进行计算,以同一个物质的化学反应速率进行比较.
解答:
解:A.v(SO3)=4 mol?L-1?min-1;
B.v(O2):v(SO3)=1:2,故v(SO3)=2v(O2)=2×2 mol?L-1?min-1=4 mol?L-1?min-1;
C.v(SO2):v(SO3)=1:1,故v(SO3)=2v(SO2)=5 mol?L-1?min-1;
D.v(SO2):v(SO3)=1:1,故v(SO3)=2v(SO2)=0.1 mol?L-1?S-1=0.1×60=6 mol?L-1?min-1;
故D反应速率最快,
故选D.
B.v(O2):v(SO3)=1:2,故v(SO3)=2v(O2)=2×2 mol?L-1?min-1=4 mol?L-1?min-1;
C.v(SO2):v(SO3)=1:1,故v(SO3)=2v(SO2)=5 mol?L-1?min-1;
D.v(SO2):v(SO3)=1:1,故v(SO3)=2v(SO2)=0.1 mol?L-1?S-1=0.1×60=6 mol?L-1?min-1;
故D反应速率最快,
故选D.
点评:本题考查化学反应速率的相关计算,把握化学反应速率之比等化学计量数之比为解答的关键,难度不大.要注意比较化学反应速率快慢要以同一个物质进行比较.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列氧化物中,既溶于氢氧化钠溶液又溶于盐酸的( )
| A、SiO2 |
| B、Al2O3 |
| C、Fe2O3 |
| D、CuO |
下列说法正确的是( )
| A、电离时能生成H+的化合物是酸 |
| B、水溶液显碱性的物质是碱 |
| C、电解质电离时产生的阴离子全部是OH-的化合物是碱 |
| D、能与碱发生反应生成水的化合物是酸 |
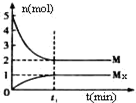 E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:xM(g)?Mx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )
E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:xM(g)?Mx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )| A、该反应的化学方程式是2HF?(HF)2 | ||
B、t1时刻,保持温度不变,再充入1molM,重新达到平衡时,
| ||
| C、平衡时混合气体的平均摩尔质量是33.3 | ||
| D、M的沸点比同主族下一周期元素的气态氢化物沸点低 |
关于如图所示的原电池,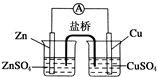 下列说法正确的是( )
下列说法正确的是( )
 下列说法正确的是( )
下列说法正确的是( )| A、盐桥中的阴离子向硫酸铜溶液中迁移 |
| B、锌电极发生还原反应,铜电极发生氧化反应 |
| C、铜电极上发生的电极反应是2H++e-→H2↑ |
| D、电子从锌电极通过检流计流向铜电极 |
已知反应A2+B2=2AB,断开1molA2中的化学键消耗的能量为Q1 kJ,断开1molB2中的化学键消耗的能量为Q2kJ,生成1molAB中的化学键释放的能量为Q3kJ,则下列说法正确的是( )
| A、若A2和B2的总能量之和大于生成的2AB的总能量,则反应放热 |
| B、若A2和B2的总能量之和小于生成的2AB的总能量,则反应放热 |
| C、若该反应为放热反应,则Q1+Q2>Q3 |
| D、若该反应为吸热反应,则Q1+Q2<Q3 |