��Ŀ����
6��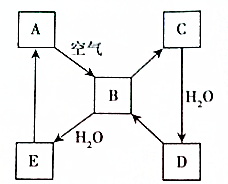 ��ͼ��ʾij��̬����A���仯����֮���ת����ϵ��ijЩ����ͷ�Ӧ��������ȥ����������B�ڳ��³�ѹ��Ϊ���壬B��C����Է�������֮��Ϊ4��5��������D����Ҫ�Ĺ�ҵԭ�ϣ�
��ͼ��ʾij��̬����A���仯����֮���ת����ϵ��ijЩ����ͷ�Ӧ��������ȥ����������B�ڳ��³�ѹ��Ϊ���壬B��C����Է�������֮��Ϊ4��5��������D����Ҫ�Ĺ�ҵԭ�ϣ���1��д���������ʵ����ƣ�A��C��������
��2��д��E������NaOH��Һ��Ӧ�����ӷ���ʽ��H2SO3+OH-�THSO3-+H2O
��3��д��������D�ֱ�ͽ������ʡ��ǽ������ʷ�Ӧ����B�Ļ�ѧ����ʽ��C+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CO2��+2SO2��+2H2O��Cu+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+SO2��+2H2O��
���� ��̬����A��������е�������Ӧ������������B����A����ΪC��S�ȣ��ٶ�ΪS����BΪSO2��CΪSO3�����ǵ���Է�������Ϊ64��80=4��5��ǡ�������������ͬʱҲ֤��A����C������DΪH2SO4������һ����Ҫ�Ĺ�ҵԭ�ϣ�������Ҳ�������һ��֤��AΪS��EΪH2SO3��������ʵ������Լ���ĿҪ��ɽ����⣮
��� �⣺��̬����A��������е�������Ӧ������������B����A����ΪC��S�ȣ��ٶ�ΪS����BΪSO2��CΪSO3�����ǵ���Է�������Ϊ64��80=4��5��ǡ�������������ͬʱҲ֤��A����C������DΪH2SO4������һ����Ҫ�Ĺ�ҵԭ�ϣ�������Ҳ�������һ��֤��AΪS��EΪH2SO3��
��1�������Ϸ�����֪AΪ��CΪ�������ʴ�Ϊ������������
��2��EΪH2SO3��������NaOH��Ӧ����NaHSO3����Ӧ�����ӷ���ʽΪH2SO3+OH-�THSO3-+H2O���ʴ�Ϊ��H2SO3+OH-�THSO3-+H2O��
��3��Ũ�������C��Cu�Ȼ�ԭ�������ڼ��ȵ������·�Ӧ����SO2����Ӧ�ķ���ʽ��ΪC+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CO2��+2SO2��+2H2O��Cu+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+SO2��+2H2O�ȣ�
�ʴ�Ϊ��C+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CO2��+2SO2��+2H2O��Cu+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+SO2��+2H2O��
���� ���⿼��������ƶϣ�ע������������Ӧ��������Ĺ��嵥����C��S��Ԫ�أ����Դ���Ϊ�����ͻ�ƿڽ����ƶϣ�ע��������ʵĻ�ѧ���ʣ���������д��Ӧ�Ļ�ѧ����ʽ��

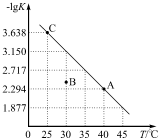 ��һ������������泥�NH2COONH4�������ܱ������У���һ�������·������з�Ӧ��NH2COONH4��s��?2NH3��g��+CO2��g�����÷�Ӧ��ƽ�ⳣ���ĸ�������-lgK��ֵ���¶ȣ�T���ı仯������ͼ��ʾ������˵������ȷ���ǣ�������
��һ������������泥�NH2COONH4�������ܱ������У���һ�������·������з�Ӧ��NH2COONH4��s��?2NH3��g��+CO2��g�����÷�Ӧ��ƽ�ⳣ���ĸ�������-lgK��ֵ���¶ȣ�T���ı仯������ͼ��ʾ������˵������ȷ���ǣ�������| A�� | �÷�Ӧ�ġ�H��0 | |
| B�� | 30��ʱ��B���Ӧ״̬��v��������v���棩 | |
| C�� | A���Ӧ״̬��ƽ�ⳣ��K��A��=10-2.294 | |
| D�� | NH3�������������ʱ���÷�Ӧһ���ﵽƽ��״̬ |
| A�� | HCl������ʯ��ˮ�� | B�� | NO2��H2O�� | C�� | SO2��H2O2��Һ�� | D�� | Cl2��NaOH��Һ�� |
| A�� | MgCl2 | B�� | FeSO4 | C�� | Na2SO3 | D�� | ZnSO4 |
| A�� | ��ɫ�����м���KI������BaCl2 | B�� | ��ɫ�����м���NaBr������BaCl2 | ||
| C�� | ��ɫ�����п�����KI | D�� | ��ɫ�����п���û��NaBr |
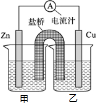 ��1����֪���Ȼ�ѧ����ʽ��
��1����֪���Ȼ�ѧ����ʽ��