题目内容
11.一个体重50kg的健康人约含铁2g.正常人体每日需铁量为11.5mg.某种补铁药品标签上注明:每100mL含FeSO4450~460mg.实验室为测定这种补铁药品的含铁量,做了以下实验:取20.00mL该药品,把0.01mol/L KMnO4溶液逐滴加入到该溶液中,当加入12.00mL时,紫色不在褪去,反应的离子方程式为:MnO${\;}_{4}^{-}$+5Fe2++8H+═Mn2++5Fe3++4H2O
问:(1)20.00mL溶液中含Fe2+的物质的量是6×10-4mol
(2)通过计算说明,测得的结果是否符合药品标签上的注明范围?
分析 (1)根据n=cV计算出滴定20mL药品中硫酸亚铁消耗的高锰酸钾的物质的量,然后结合反应方程式计算出20mL该药品中含有的亚铁离子的物质的量;
(2)根据(1)的计算可计算出100mL该药品中含有的硫酸亚铁的物质的量,再根据m=nM计算出含有硫酸亚铁的质量,根据计算结果进行判断是否符合药品标签上的注明范围.
解答 解:(1)12mL 0.01mol/L KMnO4溶液中含有高锰酸钾的物质的量为:0.01mol/L×0.012L=1.2×10-4mol,
根据反应MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O可知,1.2×10-4mol高锰酸钾完全反应消耗Fe2+的物质的量为:1.2×10-4mol×5=6×10-4mol,
说明20.00mL该药品中含有Fe2+的物质的量为6×10-4mol,
故答案为:6×10-4mol;
(2)根据(1)可知20.00mL该药品中含有Fe2+的物质的量为6×10-4mol,
则100mL该药品中Fe2+的物质的量为:6×10-4mol×$\frac{100mL}{20mL}$=3×10-3mol,
则100mL该药品中含有FeSO4的物质的量为3×10-3mol,质量为:152g/mol×3×10-3mol=0.456g=456mg,介于450~460mg之间,
所以该药品中FeSO4的含量符合药品标签上的注明范围,
答:该药品中FeSO4的含量符合药品标签上的注明范围.
点评 本题考查了离子方程式的计算,题目难度中等,明确物质的量与摩尔质量、物质的量浓度之间的关系为解答关键,试题充分考查了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
1.以硫酸铜溶液作电解液,对含有杂质Fe、Zn、Ag的粗铜进行电解精炼.下列叙述正确的是( )
| A. | 粗铜与直流电源负极相连 | |
| B. | 相同时间内阳极质量变化与阴极质量变化可能不同 | |
| C. | 硫酸铜溶液浓度始终保持不变 | |
| D. | 杂质Ag以Ag2SO4的形式沉入电解槽形成“阳极泥” |
2.下列对化学反应的认识,不正确的是( )
| A. | 化学反应过程中,分子的种类和数目一定发生改变 | |
| B. | 化学反应涉及化学键的断裂和生成,而且还伴随着能量的变化 | |
| C. | 化学反应速率的大小主要取决于反应物的本身性质 | |
| D. | CO2(g)+C(s)?2CO(g)△H>0,△S>0,该反应常温下不能自发进行 |
19.根据下列实验现象所得出的结论正确的是( )
| 选项 | 实验操作(或设计) | 实验现象 | 结论 |
| A | 向溶液中滴加经盐酸酸化的BaCl2溶液 | 溶液中产生白色沉淀 | 溶液中含有SO42- |
| B | 以镁、铝、氢氧化钠溶液构成原电池 | 镁表面有气泡产生 | 镁作原电池的负极 |
| C | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升化 |
| D | 向KI溶液中滴入少量溴水和苯,振荡、静置 | 上层溶液呈紫红色 | I-的还原性强于Br- |
| A. | A | B. | B | C. | C | D. | D |
9.有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
为了鉴别上述化合物.分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其它均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀完全溶解;
③进行焰色反应,B、C为紫色(透过蓝色钴玻璃),A、E为黄色;
④在各溶液中加入氯化钡溶液,再加过量稀盐酸,A中放出无色气体,C、D中产生白色沉淀,B中无明显现象.
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验写出A、B、C的化学式:
ANaHCO3 BKNO3; CKAl(SO4)2.
| 阳离子 | K+、Na+、Al3+、Cu2+ |
| 阴离子 | OH-、HCO3-、NO3-、SO42- |
①将它们溶于水后,D为蓝色溶液,其它均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀完全溶解;
③进行焰色反应,B、C为紫色(透过蓝色钴玻璃),A、E为黄色;
④在各溶液中加入氯化钡溶液,再加过量稀盐酸,A中放出无色气体,C、D中产生白色沉淀,B中无明显现象.
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验写出A、B、C的化学式:
ANaHCO3 BKNO3; CKAl(SO4)2.
6.下列有关实验装置及用途叙述正确的是( )
| A. |  装置用于检验消去产物 | B. | 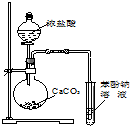 装置检验酸性:盐酸>碳酸>苯酚 | ||
| C. | 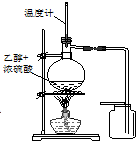 装置用于实验室制取并收集乙烯 | D. | 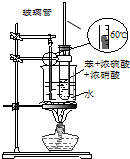 装置用于实验室制硝基苯 |
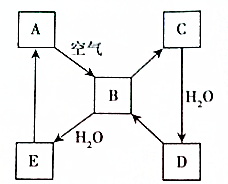 如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.