题目内容
4.有一包白色固体,可能含有KI、NaBr、BaCl2中的一种或两种物质.将白色物质溶入水得无色溶液,在该溶液中加入少量稀硫酸,有白色沉淀产生;在无色溶液中加入新制取的氯水,然后再滴入淀粉溶液,溶液变为蓝色.下列推断正确的是( )| A. | 白色固体中既有KI,又有BaCl2 | B. | 白色固体中既有NaBr,又有BaCl2 | ||
| C. | 白色固体中可能有KI | D. | 白色固体中可能没有NaBr |
分析 将白色物质溶入水得无色溶液,在该溶液中加入少量稀硫酸,有白色沉淀产生,所以一定含有BaCl2;在无色溶液中加入新制取的氯水,然后再滴入淀粉溶液,溶液变为蓝色,所以一定含有KI,据此回答.
解答 解:将白色物质溶入水得无色溶液,在该溶液中加入少量稀硫酸,有白色沉淀产生,所以一定含有BaCl2;在无色溶液中加入新制取的氯水,然后再滴入淀粉溶液,溶液变为蓝色,所以一定含有KI,故选A.
点评 本题考查了混合物组成的推断,完成此题,可以结合题干提供的实验现象根据物质的性质进行,难度不大.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
8.乙醇(C2H5OH)和二甲醚(CH3OCH3)互为同分异构体且二甲醚不与钠反应.仅含碳、氢、氧三种元素的某化合物,其相对分子质量为88,且氧的质量分数为18.18%.已知该化合物不与钠反应,则该化合物的结构共有(不考虑立体异构)( )
| A. | 2种 | B. | 5种 | C. | 6种 | D. | 8种 |
13.不能同时满足在溶液和非溶液状态下发生置换反应的是( )
| A. | 金属单质置换金属单质 | B. | 金属单质置换非金属单质 | ||
| C. | 非金属单质置换金属单质 | D. | 非金属单质置换非金属单质 |
9.有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
为了鉴别上述化合物.分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其它均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀完全溶解;
③进行焰色反应,B、C为紫色(透过蓝色钴玻璃),A、E为黄色;
④在各溶液中加入氯化钡溶液,再加过量稀盐酸,A中放出无色气体,C、D中产生白色沉淀,B中无明显现象.
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验写出A、B、C的化学式:
ANaHCO3 BKNO3; CKAl(SO4)2.
| 阳离子 | K+、Na+、Al3+、Cu2+ |
| 阴离子 | OH-、HCO3-、NO3-、SO42- |
①将它们溶于水后,D为蓝色溶液,其它均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀完全溶解;
③进行焰色反应,B、C为紫色(透过蓝色钴玻璃),A、E为黄色;
④在各溶液中加入氯化钡溶液,再加过量稀盐酸,A中放出无色气体,C、D中产生白色沉淀,B中无明显现象.
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验写出A、B、C的化学式:
ANaHCO3 BKNO3; CKAl(SO4)2.
16.在抗震救灾中要用大量漂白粉和漂白液杀菌消毒.下列说法正确的是( )
| A. | 漂白粉是混合物,漂粉精是纯净物 | |
| B. | 工业上将氯气通入澄清石灰水制取漂白粉 | |
| C. | 漂白粉的有效成分是Ca(ClO)2 | |
| D. | 漂白液的有效成份是Na2O2 |
14.防冻剂是一种能在低温下防止物料中水分结冰的物质.下列可用于防冻剂的物质中,含有氮元素的有机物是( )
| A. | 甲醇[CH3OH] | B. | 氯化钙[CaCl2] | C. | 尿素[CO(NH2)2] | D. | 亚硝酸钠[NaNO2] |
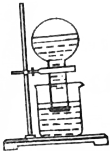 甲同学按如图所示装置做新制氯水受日光照射分解放出O2的验证实验,结果现象不明显.
甲同学按如图所示装置做新制氯水受日光照射分解放出O2的验证实验,结果现象不明显.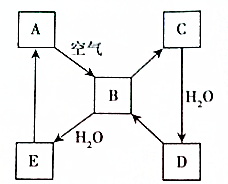 如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料. 某化学小组设计了如图所示装置.用以探究Cu跟浓H2SO4的反应并收集少量气态产物(加热及夹持装置省略).
某化学小组设计了如图所示装置.用以探究Cu跟浓H2SO4的反应并收集少量气态产物(加热及夹持装置省略).