题目内容
17.已知SO2+H2O2═H2SO4.将贮满干燥的某种气体的试管倒置于某种液体(括号内物质为液体,且液体足量)中,轻轻震荡,液体可以充满试管.该气体不可能是( )| A. | HCl(澄清石灰水) | B. | NO2(H2O) | C. | SO2(H2O2溶液) | D. | Cl2(NaOH溶液) |
分析 水可以充满试管,说明气体全部溶于水或与水反应,且没有气体生成,依据物质的性质及发生反应解答.
解答 解:A.氯化氢易溶于水,可使溶液充满试管,故A不选;
B.二氧化氮与水反应生成一氧化氮,一氧化氮不溶于水,所以溶液不会充满试管,故B选;
C.二氧化硫易溶于水,可使溶液充满试管,故C不选;
D.氯气与氢氧化钠溶液完全反应,能够被氢氧化钠完全吸收,所以溶液可以充满试管,故D不选;
故选:B.
点评 本题综合考查元素化合物知识,明确物质的溶解性及化学性质是解题关键,侧重考查二氧化氮的性质,题目难度不大.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
7.下列有关物质应用的说法正确的是( )
| A. | 生石灰用作食品抗氧剂 | B. | 小苏打是面包发酵粉的主要成分 | ||
| C. | 铝罐可久盛食醋 | D. | 盐类都可作调味品 |
8.乙醇(C2H5OH)和二甲醚(CH3OCH3)互为同分异构体且二甲醚不与钠反应.仅含碳、氢、氧三种元素的某化合物,其相对分子质量为88,且氧的质量分数为18.18%.已知该化合物不与钠反应,则该化合物的结构共有(不考虑立体异构)( )
| A. | 2种 | B. | 5种 | C. | 6种 | D. | 8种 |
5.在相同状况下,体积不相同的三个烧瓶中分别盛满了NH3、HCl和NO2,将它们倒扣在水槽中充分溶解后,塞住瓶口取出,烧瓶内三溶液物质的量浓度之比为( )
| A. | 1:1:1 | B. | 2:2:3 | C. | 3:3:2 | D. | 无法判断 |
12.下列物质变化过程中生成了强酸的是( )
| A. | CO2通入水中 | B. | SO3通入水中 | ||
| C. | 钠粒投入水中 | D. | 硫酸铜溶液中滴加氨水 |
2.下列对化学反应的认识,不正确的是( )
| A. | 化学反应过程中,分子的种类和数目一定发生改变 | |
| B. | 化学反应涉及化学键的断裂和生成,而且还伴随着能量的变化 | |
| C. | 化学反应速率的大小主要取决于反应物的本身性质 | |
| D. | CO2(g)+C(s)?2CO(g)△H>0,△S>0,该反应常温下不能自发进行 |
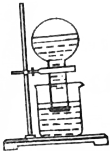 甲同学按如图所示装置做新制氯水受日光照射分解放出O2的验证实验,结果现象不明显.
甲同学按如图所示装置做新制氯水受日光照射分解放出O2的验证实验,结果现象不明显.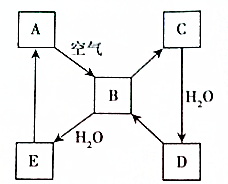 如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.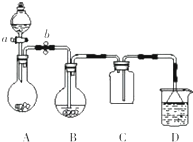 某化学小组设计了如图所示装置.用以探究Cu跟浓H2SO4的反应并收集少量气态产物(加热及夹持装置省略).
某化学小组设计了如图所示装置.用以探究Cu跟浓H2SO4的反应并收集少量气态产物(加热及夹持装置省略).