题目内容
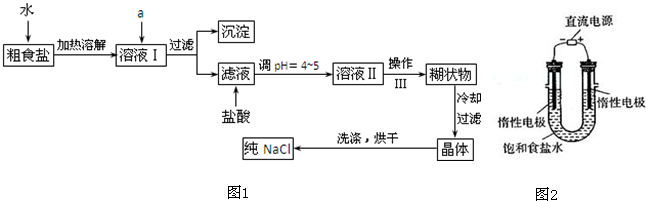
氯化铜 (CuCl2?2H2O)中含FeCl2杂质.为制得纯净氯化铜晶体,首先将其制成酸性水溶液,然后按如图所示操作步骤进行提纯.
(1)操作I加入X的目的是 .
(2)下列适合本实验的试剂X是
A.Cl2 B.KMnO4 C.H2O2 D.H2SO4
(3)操作Ⅱ的名称为
(4)操作Ⅲ的程序依次为 、 、过滤、自然干燥、得到CuCl2?2H2O晶体.
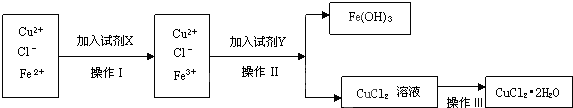
(1)操作I加入X的目的是
(2)下列适合本实验的试剂X是
A.Cl2 B.KMnO4 C.H2O2 D.H2SO4
(3)操作Ⅱ的名称为
(4)操作Ⅲ的程序依次为

考点:物质分离和提纯的方法和基本操作综合应用
专题:
分析:向含有Cu2+、Cl-、Fe2+溶液中加入试剂X得到Cu2+、Cl-、Fe3+,根据离子变化知,Fe2+转化为Fe3+,除去Fe2+但不能引进杂质,所以X试剂为Cl2或H2O2,向溶液中加入试剂Y并调节溶液的pH得到Fe(OH)3和CuCl2溶液,且不能引进新的杂质,所以Y可能是CuO或Cu(OH)2或CuCO3,分离难溶性固体和溶液采用过滤方法,从溶液中得到固体,应该采用蒸发浓缩、冷却结晶的方法,所以操作III是加热浓缩、冷却结晶,据此分析解答.
解答:
解:向含有Cu2+、Cl-、Fe2+溶液中加入试剂X得到Cu2+、Cl-、Fe3+,根据离子变化知,Fe2+转化为Fe3+,除去Fe2+但不能引进杂质,所以X试剂为Cl2或H2O2,向溶液中加入试剂Y并调节溶液的pH得到Fe(OH)3和CuCl2溶液,且不能引进新的杂质,所以Y可能是CuO或Cu(OH)2或CuCO3,分离难溶性固体和溶液采用过滤方法,从溶液中得到固体,应该采用蒸发浓缩、冷却结晶的方法,所以操作III是加热浓缩、冷却结晶,
(1)通过以上分析知,操作I加入X的目的是除去溶液中的Fe2+,将溶液中Fe2+氧化为Fe3+,故答案为:使溶液中Fe2+氧化为Fe3+;
(2)除杂时要除去杂质且不能引进新的杂质,硫酸和高锰酸钾溶液氧化亚铁离子都产生新的杂质,氯气和双氧水氧化亚铁离子都生成铁离子,且不引进新的杂质,故选AC;
(3)分离难溶性固体和溶液采用过滤方法,所以操作Ⅱ的名称为过滤,故答案为:过滤;
(4)从溶液中提取固体,应该采用蒸发浓缩、冷却结晶、过滤、自燃干燥的方法,故答案为:蒸发浓缩、冷却结晶.
(1)通过以上分析知,操作I加入X的目的是除去溶液中的Fe2+,将溶液中Fe2+氧化为Fe3+,故答案为:使溶液中Fe2+氧化为Fe3+;
(2)除杂时要除去杂质且不能引进新的杂质,硫酸和高锰酸钾溶液氧化亚铁离子都产生新的杂质,氯气和双氧水氧化亚铁离子都生成铁离子,且不引进新的杂质,故选AC;
(3)分离难溶性固体和溶液采用过滤方法,所以操作Ⅱ的名称为过滤,故答案为:过滤;
(4)从溶液中提取固体,应该采用蒸发浓缩、冷却结晶、过滤、自燃干燥的方法,故答案为:蒸发浓缩、冷却结晶.
点评:本题考查混合物的分离和提纯,涉及除杂、物质分离方法的选取等知识点,明确物质的性质是解本题关键,知道常见物质的分离方法,注意除杂时不能引进新的杂质,题目难度不大.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
天然碱的组成可以用aNa2CO3?bNaHCO3?cH2O(a、b、c为整数)表示.通过以下实验测定某天然碱的化学式,将质量为12.45g的某天然碱溶于水,逐滴滴加某浓度的稀盐酸,产生气体的体积与加入盐酸的体积(标准状况)的关系如下表所示:下列说法错误的是( )
| 盐酸体积(mL) | 20 | 40 | 60 | 80 |
| 产生气体体积(mL) | 0 | 560 | 1680 | 2520 |
| A、加入盐酸体积小于20 mL时,体系发生的离子反应为:CO32-+H+═HCO3- |
| B、加入盐酸体积为50 mL时,产生气体(标准状况)的体积为1120mL |
| C、本实验使用盐酸的浓度为2.5 mol?L-1 |
| D、该天然碱的化学式为Na2CO3?2NaHCO3?2H2O |
如图是制取气体的一种装置,能用此装置制取气体并能“随开随用,随关随停”的是( )

| A、二氧化锰与浓盐酸制Cl2 |
| B、过氧化钠与水制O2 |
| C、锌与稀硫酸制H2 |
| D、电石与水制取C2H2 |
NaCl是一种重要的化工原料,如图所示,可以制备一系列物质.下列说法正确的是( )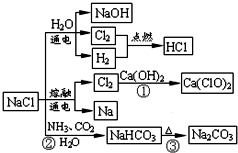

| A、反应②③是侯氏制碱法的原理 |
| B、反应①中的Ca(ClO)2是还原产物 |
| C、常温下干燥Cl2可储存于钢瓶中,所以Cl2与铁不反应 |
| D、图中所示转化反应都是氧化还原反应 |
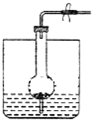
观察如图装置,下列说法正确的是( )
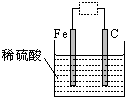

| A、虚线框中接灵敏电流计,铁被腐蚀,并能将电能转化为化学能 |
| B、虚线框中保持断开状态,铁可能不会被腐蚀 |
| C、虚线框中接直流电源,铁可能不会被腐蚀 |
| D、虚线框中无论接灵敏电流计还是直流电源,铁都会加快腐蚀 |