题目内容
NaCl是一种重要的化工原料,如图所示,可以制备一系列物质.下列说法正确的是( )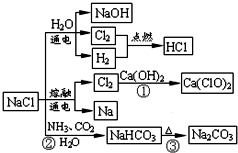

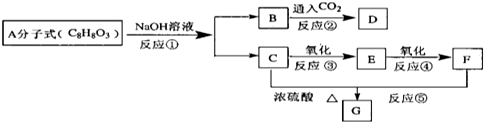
| A、反应②③是侯氏制碱法的原理 |
| B、反应①中的Ca(ClO)2是还原产物 |
| C、常温下干燥Cl2可储存于钢瓶中,所以Cl2与铁不反应 |
| D、图中所示转化反应都是氧化还原反应 |
考点:氯、溴、碘及其化合物的综合应用
专题:
分析:A.侯氏制碱法的原理即:①NaCl(饱和)+NH3+H2O+CO2=NH4Cl+NaHCO3↓,②2NaHCO3
Na2CO3+H2O+CO2↑;
B.Cl2的化合价为0价,Ca(ClO)2中Cl的化合价为+1价;
C.Cl2与铁在点燃火加热条件下能反应;
D.NaCl生成NaHCO3,以及NaHCO3分解生成Na2CO3的反应不是氧化还原反应.
| ||
B.Cl2的化合价为0价,Ca(ClO)2中Cl的化合价为+1价;
C.Cl2与铁在点燃火加热条件下能反应;
D.NaCl生成NaHCO3,以及NaHCO3分解生成Na2CO3的反应不是氧化还原反应.
解答:
解:A.侯氏制碱法的原理即:①NaCl(饱和)+NH3+H2O+CO2=NH4Cl+NaHCO3↓,②2NaHCO3
Na2CO3+H2O+CO2↑,故A正确;
B.Cl2的化合价为0价,Ca(ClO)2中Cl的化合价为+1价,化合价升高,Ca(ClO)2是氧化产物,故B错误;
C.常温下干燥的Cl2不与铁反应,但在点燃火加热条件下能反应,故C错误;
D.NaCl生成NaHCO3,以及NaHCO3分解生成Na2CO3的反应都不是氧化还原反应,故D错误.
故选:A.
| ||
B.Cl2的化合价为0价,Ca(ClO)2中Cl的化合价为+1价,化合价升高,Ca(ClO)2是氧化产物,故B错误;
C.常温下干燥的Cl2不与铁反应,但在点燃火加热条件下能反应,故C错误;
D.NaCl生成NaHCO3,以及NaHCO3分解生成Na2CO3的反应都不是氧化还原反应,故D错误.
故选:A.
点评:本题考查氯气的化学性质,题目难度中等,易错点为D,注意化合价的变化.

练习册系列答案
相关题目
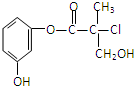 某有机物A是生产有机农药“杀螨灵”的一种中间体,其结构简式如图.则下列叙述正确的是( )
某有机物A是生产有机农药“杀螨灵”的一种中间体,其结构简式如图.则下列叙述正确的是( )| A、有机物A属于芳香烃 |
| B、有机物A与 Br2的CCl4溶液容易发生加成反应 |
| C、有机物A和浓硫酸混合加热,可以发生消去反应 |
| D、1mol A和足量的NaOH溶液反应,最多可以消耗4mol NaOH |
在碱性溶液中能大量共存且为无色透明溶液的是( )
| A、K+ Cl- MnO4- SO42- |
| B、Ca2+ CO32- NO3- SO42- |
| C、Na+ HCO3- NO3- SO42- |
| D、Na+ SO42- NO3- Cl- |
对于常温下pH=3的乙酸溶液,下列说法正确的是( )
| A、溶液中粒子浓度大小关系为:c(H+)>c(CH3COO-)>c(CH3COOH)>c(OH-) |
| B、加水稀释到原体积的10倍后溶液pH变为4 |
| C、加入少量乙酸钠固体,溶液pH升高 |
| D、与等体积、pH=3的盐酸比较,跟足量锌粒反应产生的H2一样多 |
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )


| A、反应开始2分钟内平均反应速率最大 |
| B、反应4分钟后平均反应速率最小 |
| C、反应开始4分钟内温度对反应速率的影响比浓度大 |
| D、反应在第2min到第4min间生成CO2的平均反应速率最大 |
下列物质属于强电解质且能导电的是( )
①氯化钠溶液 ②氯化铵固体 ③铜 ④石墨 ⑤熔融NaOH ⑥稀硫酸 ⑦乙酸.
①氯化钠溶液 ②氯化铵固体 ③铜 ④石墨 ⑤熔融NaOH ⑥稀硫酸 ⑦乙酸.
| A、⑤ | B、①②⑥ |
| C、②⑤⑥⑦ | D、①③④⑤⑥ |