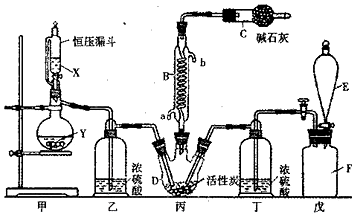
题目内容
11.用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一.(1)Fe还原水体中NO3-的反应原理如图1所示.

②作负极的物质是铁.
②正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如表:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 |  |  |
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如右图2所示,可得到的结论是本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率.
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4.结合该反应的离子方程式,解释加入Fe2+提高NO3-去除率的原因:Fe2++2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移.pH=4.5(其他条件相同)
分析 (1)①Fe还原水体中NO3-,根据题意Fe3O4为电解质,则Fe作还原剂,失去电子,作负极;
②NO3-在正极得电子发生还原反应产生NH4+,根据图2信息可知为酸性环境;
(2)由于Fe3O4为电解质,而电解质主要作用是为电子转移提供媒介,然后根据FeO(OH)不导电进行分析;
(3)①根据图2中的三个实验结果进行分析;
②结合(2)题中的铁的最终物质形态结果差异进行分析.
解答 解:(1)①Fe还原水体中NO3-,则Fe作还原剂,失去电子,作负极,
故答案为:铁;
②NO3-在正极得电子发生还原反应产生NH4+,根据图2信息可知为酸性环境,则正极的电极反应式为:NO3-+8e-+10H+=NH4++3H2O,
故答案为:NO3-+8e-+10H+=NH4++3H2O;
(2)pH越高,Fe3+越易水解生成FeO(OH),而FeO(OH)不导电,阻碍电子转移,所以NO3-的去除率低.
故答案为:FeO(OH)不导电,阻碍电子转移;
(3)①从图2的实验结果可以看出,单独加入Fe2+时,NO3-的去除率为0,因此得出Fe2+不能直接还原NO3-;而Fe和Fe2+共同加入时NO3-的去除率比单独Fe高,因此可以得出结论:本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率.
故答案为:本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率;
②同位素示踪法证实了Fe2+能与FeO(OH)反应生成Fe3O4,离子方程式为:Fe2++2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移.
故答案为:Fe2++2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移.
点评 本题主要考查化学反应原理,涉及电化学、氧化还原反应等相关知识,题中的Fe与NO3-的反应跟溶液酸碱性有关,抓住这一点是解题的关键,难度不大.

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案| A. | 对燃烧煤时产生的尾气进行除硫处理 | |
| B. | 往已经酸化的土壤撒石灰中和 | |
| C. | 煤燃烧时鼓入足量空气 | |
| D. | 将煤除硫后再燃烧 |
请根据如图1示意图回答(1)、(2)有关问题:
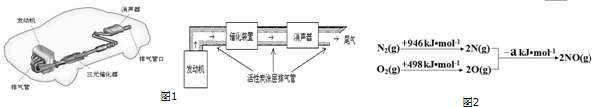
(1)汽车发动机工作时会引发N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1,其能量变化示意图如图2:
则NO中氮氧键的键能为632 kJ•mol-1.
(2)利用活性炭涂层排气管处理NOx的反应为:xC(s)+2NOx(g)?N2(g)+xCO2 (g)△H=-b kJ•mol-1.若使NOx更加有效的转化为无毒尾气排放,以下措施理论上可行的是AD.
A.增加排气管长度 B.增大尾气排放口 C.升高排气管温度 D.添加合适的催化剂
(3)工业上一般采用下列两种反应合成甲醇:
反应a:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.5kJ•mol-1
反应b:CO (g)+2H2(g)?CH3OH(g)△H=-91.8kJ•mol-1
①对于反应a,某温度下,将4.0mol CO2(g)和12.0mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,测得甲醇蒸气的体积分数为30%,则该温度下反应的平衡常数为1.33;
②对于反应b,在763K、3.04×104kPa时,用CO和H2做原料合成CH3OH,当原料中CO和H2的比例不同时,对CO的转化率及平衡混合物中甲醇的体积分数都有影响.设H2和CO起始物质的量之比为m,平衡时CO的转化率为α,平衡混合物中甲醇的体积分数为y,则m、α、y三者的关系式为y=$\frac{α}{1+m+2a}$
(i)请根据上述关系式将如表空白填满:
| m | α | y |
| 1 | 0.25 | 16.67% |
| 2 | 0.45 | |
| 3 | 0.56 | 19.35% |
(4)CO可以合成二甲醚,二甲醚可以作为燃料电池的原料,化学反应原理为:
CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H<0
①在恒容密闭容器里按体积比为1:4充入一氧化碳和氢气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是D;
A.逆反应速率先增大后减小
B.通入一定量的He,体系压强增大
C.正反应速率先减小后增大
D.化学平衡常数K值增大
②已知参与电极反应的电极材料单位质量放出电能的大小称为该电池的比能量.关于二甲醚碱性燃料电池与乙醇碱性燃料电池,下列说法正确的是AC(填字母)
A.两种燃料互为同分异构体,分子式和摩尔质量相同,但比能量不相同
B.两种燃料所含共价键数目相同,断键时所需能量相同,比能量相同
C.两种燃料所含共价键类型不同,断键时所需能量不同,比能量不同
③已知甲醇的热值是23kJ•g-1,请写出表示甲醇燃烧热的热化学方程式CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-736kJ/mol.
| A. | 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q | |
| B. | 若温度不变,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的$\frac{1}{2}$要小 | |
| C. | 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a | |
| D. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n |
| A. | 过滤操作中,玻璃棒应适时搅拌漏斗器 | |
| B. | 蒸发时,不能把蒸发皿放置于石棉网上加热 | |
| C. | 萃取分液时,将塞上凹槽或小孔对准漏斗上小孔,然后打开活塞才能放出下层液体 | |
| D. | 配制容量瓶,定容时改用胶头滴管滴加蒸馏水 |
| A. | 试管 | B. | 蒸发皿 | C. | 坩埚 | D. | 烧杯 |