题目内容
14.298K时,合成氨反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol,在该温度下,取1mol N2和3mol H2放在密闭容器内反应.下列说法正确的是( )| A. | 在有催化剂存在的条件下,反应放出的热量为92.4 kJ | |
| B. | 有无催化剂该反应放出的热量都为92.4 kJ | |
| C. | 若再充入1 mol H2,到达平衡时放出的热量应为92.4 kJ | |
| D. | 反应放出的热量始终小于92.4 kJ |
分析 A.合成氨反应为可逆反应;
B.催化剂对平衡移动无影响;
C.再充入1 mol H2,平衡正向移动,但1mol氮气不能完全转化;
D.1mol N2和3mol H2放在密闭容器内反应,一定不能完全转化.
解答 解:A.合成氨反应为可逆反应,则在有催化剂存在的条件下,反应放出的热量一定小于92.4 kJ,故A错误;
B.催化剂对平衡移动无影响,则有无催化剂该反应放出的热量小于92.4 kJ,故B错误;
C.再充入1 mol H2,平衡正向移动,但1mol氮气不能完全转化,则到达平衡时放出的热量应小于92.4 kJ,故C错误;
D.1mol N2和3mol H2放在密闭容器内反应,一定不能完全转化,则反应放出的热量始终小于92.4 kJ,故D正确;
故选D.
点评 本题考查反应热及焓变,为高频考点,把握热化学方程式的意义及平衡移动为解答的关键,侧重分析与应用能力的考查,注意可逆反应的特点,题目难度不大.

练习册系列答案
相关题目
16.下列仪器经常用于物质分离的有( )
①漏斗②试管③蒸馏烧瓶④天平⑤分液漏斗⑥容量瓶⑦蒸发皿⑧坩埚.
①漏斗②试管③蒸馏烧瓶④天平⑤分液漏斗⑥容量瓶⑦蒸发皿⑧坩埚.
| A. | ①③⑤⑥ | B. | ①②④⑥ | C. | ①③⑤⑦ | D. | ①③⑤⑧ |
5.科学研究、工业生产和日常生活都离不开物质的制备.
(一)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)?4NO2(g)+O2(g);△H>0
(1)反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将减小(填“增大”、“减小”、“不变”).
(2)表为反应在T温度下的部分实验数据:
则,500s内N2O5的分解速率为0.003mol•L-1•s-1;
(3)在T2温度下,反应1000s时测得N2O5的浓度为3.00mol•L-1.则T2<T1.(填“>”“=”或“<”)
(二)工业上用重晶石(主要成分为BaSO4)制备BaCl2
(1)步骤①中BaSO4与碳在高温下反应,每1mol碳生成CO需要吸收142.8kJ的热量,此反应的热化学方程式为BaSO4(s)+4C(s)═4CO(g)+BaS(s)△H=+571.2kJ/mol;
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=2.7×10-3;[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)若NaOH溶液吸收H2S气体生成等物质的量的Na2S和NaHS,则溶液中各离子浓度由大到小的顺序为c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+).
(一)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)?4NO2(g)+O2(g);△H>0
(1)反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将减小(填“增大”、“减小”、“不变”).
(2)表为反应在T温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.50 | 2.50 |
(3)在T2温度下,反应1000s时测得N2O5的浓度为3.00mol•L-1.则T2<T1.(填“>”“=”或“<”)
(二)工业上用重晶石(主要成分为BaSO4)制备BaCl2
(1)步骤①中BaSO4与碳在高温下反应,每1mol碳生成CO需要吸收142.8kJ的热量,此反应的热化学方程式为BaSO4(s)+4C(s)═4CO(g)+BaS(s)△H=+571.2kJ/mol;
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=2.7×10-3;[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)若NaOH溶液吸收H2S气体生成等物质的量的Na2S和NaHS,则溶液中各离子浓度由大到小的顺序为c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+).
2.汽车尾气排放的一氧化碳、氮氧化物等气体已成为大气污染的主要来源.德国大众汽车尾气检测造假事件引起全世界震惊.同时能源又是制约国家发展进程的因素之一.甲醇、二甲醚等被称为21世纪的绿色能源,工业上可利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
请根据如图1示意图回答(1)、(2)有关问题:
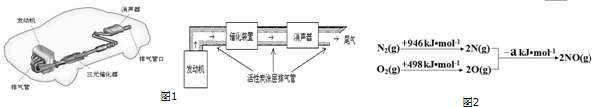
(1)汽车发动机工作时会引发N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1,其能量变化示意图如图2:
则NO中氮氧键的键能为632 kJ•mol-1.
(2)利用活性炭涂层排气管处理NOx的反应为:xC(s)+2NOx(g)?N2(g)+xCO2 (g)△H=-b kJ•mol-1.若使NOx更加有效的转化为无毒尾气排放,以下措施理论上可行的是AD.
A.增加排气管长度 B.增大尾气排放口 C.升高排气管温度 D.添加合适的催化剂
(3)工业上一般采用下列两种反应合成甲醇:
反应a:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.5kJ•mol-1
反应b:CO (g)+2H2(g)?CH3OH(g)△H=-91.8kJ•mol-1
①对于反应a,某温度下,将4.0mol CO2(g)和12.0mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,测得甲醇蒸气的体积分数为30%,则该温度下反应的平衡常数为1.33;
②对于反应b,在763K、3.04×104kPa时,用CO和H2做原料合成CH3OH,当原料中CO和H2的比例不同时,对CO的转化率及平衡混合物中甲醇的体积分数都有影响.设H2和CO起始物质的量之比为m,平衡时CO的转化率为α,平衡混合物中甲醇的体积分数为y,则m、α、y三者的关系式为y=$\frac{α}{1+m+2a}$
(i)请根据上述关系式将如表空白填满:
(ii)根据表中提供的数据,可得出反应物的比例对CO转化率以及平衡混合物中甲醇的体积分数影响的结论.选择最佳反应物配比是m=2,α=0.45;理由是由表中数据可知,m越大,α越大; 开始时m增大,y也随着增大,当m>2时,m增大,y减小,当m=2时,y最大 .
(4)CO可以合成二甲醚,二甲醚可以作为燃料电池的原料,化学反应原理为:
CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H<0
①在恒容密闭容器里按体积比为1:4充入一氧化碳和氢气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是D;
A.逆反应速率先增大后减小
B.通入一定量的He,体系压强增大
C.正反应速率先减小后增大
D.化学平衡常数K值增大
②已知参与电极反应的电极材料单位质量放出电能的大小称为该电池的比能量.关于二甲醚碱性燃料电池与乙醇碱性燃料电池,下列说法正确的是AC(填字母)
A.两种燃料互为同分异构体,分子式和摩尔质量相同,但比能量不相同
B.两种燃料所含共价键数目相同,断键时所需能量相同,比能量相同
C.两种燃料所含共价键类型不同,断键时所需能量不同,比能量不同
③已知甲醇的热值是23kJ•g-1,请写出表示甲醇燃烧热的热化学方程式CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-736kJ/mol.
请根据如图1示意图回答(1)、(2)有关问题:

(1)汽车发动机工作时会引发N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1,其能量变化示意图如图2:
则NO中氮氧键的键能为632 kJ•mol-1.
(2)利用活性炭涂层排气管处理NOx的反应为:xC(s)+2NOx(g)?N2(g)+xCO2 (g)△H=-b kJ•mol-1.若使NOx更加有效的转化为无毒尾气排放,以下措施理论上可行的是AD.
A.增加排气管长度 B.增大尾气排放口 C.升高排气管温度 D.添加合适的催化剂
(3)工业上一般采用下列两种反应合成甲醇:
反应a:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.5kJ•mol-1
反应b:CO (g)+2H2(g)?CH3OH(g)△H=-91.8kJ•mol-1
①对于反应a,某温度下,将4.0mol CO2(g)和12.0mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,测得甲醇蒸气的体积分数为30%,则该温度下反应的平衡常数为1.33;
②对于反应b,在763K、3.04×104kPa时,用CO和H2做原料合成CH3OH,当原料中CO和H2的比例不同时,对CO的转化率及平衡混合物中甲醇的体积分数都有影响.设H2和CO起始物质的量之比为m,平衡时CO的转化率为α,平衡混合物中甲醇的体积分数为y,则m、α、y三者的关系式为y=$\frac{α}{1+m+2a}$
(i)请根据上述关系式将如表空白填满:
| m | α | y |
| 1 | 0.25 | 16.67% |
| 2 | 0.45 | |
| 3 | 0.56 | 19.35% |
(4)CO可以合成二甲醚,二甲醚可以作为燃料电池的原料,化学反应原理为:
CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H<0
①在恒容密闭容器里按体积比为1:4充入一氧化碳和氢气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是D;
A.逆反应速率先增大后减小
B.通入一定量的He,体系压强增大
C.正反应速率先减小后增大
D.化学平衡常数K值增大
②已知参与电极反应的电极材料单位质量放出电能的大小称为该电池的比能量.关于二甲醚碱性燃料电池与乙醇碱性燃料电池,下列说法正确的是AC(填字母)
A.两种燃料互为同分异构体,分子式和摩尔质量相同,但比能量不相同
B.两种燃料所含共价键数目相同,断键时所需能量相同,比能量相同
C.两种燃料所含共价键类型不同,断键时所需能量不同,比能量不同
③已知甲醇的热值是23kJ•g-1,请写出表示甲醇燃烧热的热化学方程式CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-736kJ/mol.
9.已知:t℃下的某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为:K=$\frac{c(X)•{c}^{2}(Y)}{{c}^{2}(Z)•{c}^{2}(W)}$,有关该平衡的说法中正确的是( )
| A. | 升高温度,平衡常数K变大 | |
| B. | 增大压强,W(g)物质的量分数变大 | |
| C. | 升温,若混合气体的平均相对分子质量变小,则正反应放热 | |
| D. | 增大X浓度,平衡向正反应方向移动 |
19.对于平衡体系mA(g)+nB(g)?pC(g)+gD(g);△H<0.下列结论中错误的是( )
| A. | 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q | |
| B. | 若温度不变,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的$\frac{1}{2}$要小 | |
| C. | 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a | |
| D. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n |
3.下列有关实验操作的叙述错误的是( )
| A. | 过滤操作中,玻璃棒应适时搅拌漏斗器 | |
| B. | 蒸发时,不能把蒸发皿放置于石棉网上加热 | |
| C. | 萃取分液时,将塞上凹槽或小孔对准漏斗上小孔,然后打开活塞才能放出下层液体 | |
| D. | 配制容量瓶,定容时改用胶头滴管滴加蒸馏水 |

