题目内容
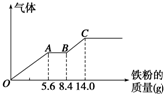 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )A、原混合酸中NO
| ||
| B、OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 | ||
| C、第二份溶液中最终溶质为FeSO4 | ||
| D、H2SO4浓度为1.25 mol?L-1 |
考点:化学方程式的有关计算,有关混合物反应的计算
专题:计算题
分析:由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑;
A.OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,根据铁的物质的量结合离子方程式计算;
B.铁先与硝酸反应生成一氧化氮与铁离子,之后铁与铁离子反应生产亚铁离子,最后是铁和硫酸反应;
C.铁先与硝酸反应,之后铁与铁离子反应生产亚铁离子,最后是铁和硫酸反应,铁单质全部转化为亚铁离子,硝酸全部起氧化剂作用,没有显酸性的硝酸;
D.加入Fe粉14gL时,完全反应,此时溶液中溶质为FeSO4,根据守恒可知n(FeSO4)=n(H2SO4),进而确定硫酸的浓度;
A.OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,根据铁的物质的量结合离子方程式计算;
B.铁先与硝酸反应生成一氧化氮与铁离子,之后铁与铁离子反应生产亚铁离子,最后是铁和硫酸反应;
C.铁先与硝酸反应,之后铁与铁离子反应生产亚铁离子,最后是铁和硫酸反应,铁单质全部转化为亚铁离子,硝酸全部起氧化剂作用,没有显酸性的硝酸;
D.加入Fe粉14gL时,完全反应,此时溶液中溶质为FeSO4,根据守恒可知n(FeSO4)=n(H2SO4),进而确定硫酸的浓度;
解答:
解:A.OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,每份溶液中n(NO3-)=n(Fe),所以原混合酸中n(NO3-)=n(HNO3)=2n(Fe)=2×
=0.2mol,故A错误;
B.由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,故B正确;
C.硝酸全部被还原,没有显酸性的硝酸,因为溶液中有硫酸根,并且铁单质全部转化为亚铁离子,所以溶液中最终溶质为FeSO4,故C正确;
D.加入Fe粉14g时,完全反应,此时溶液中溶质为FeSO4,反应消耗铁的物质的量=
=0.25mol,根据守恒可知n(H2SO4)=n(FeSO4)=n(Fe)=0.25mol,所以硫酸的浓度是
=2.5mol/L,故D错误;
故选:AD.
| 5.6g |
| 56g/mol |
B.由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,故B正确;
C.硝酸全部被还原,没有显酸性的硝酸,因为溶液中有硫酸根,并且铁单质全部转化为亚铁离子,所以溶液中最终溶质为FeSO4,故C正确;
D.加入Fe粉14g时,完全反应,此时溶液中溶质为FeSO4,反应消耗铁的物质的量=
| 14g |
| 56g/mol |
| 0.25mol |
| 0.1L |
故选:AD.
点评:本题以化学反应图象为载体,考查有关金属和酸反应的计算,难度较大,关键根据图象分析各段发生的反应,注意与铁的反应中硝酸全部起氧化剂作用为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
铝在人体内积累可使人慢性中毒,引起老年痴呆症.1989年世界卫生组织正式将铝确定为“食品污染源之一”而加以控制.铝在下列使用场合中一般无须控制的是:( )
| A、电线电缆 | B、牙膏皮 |
| C、制造炊具餐具 | D、糖果香烟包装 |
由乙醛和乙酸乙酯组成的混合物中,若含碳的质量分数为A%,则此混合物中含氢的质量分数为( )
| A、6A% | ||
B、
| ||
| C、10A% | ||
D、(100-
|
F2、Cl2、Br2、I2的氧化性递变规律依次为( )
| A、逐渐减弱 | B、逐渐增强 |
| C、变化不大 | D、无法比较 |
关于化学键的叙述中,正确的是( )
| A、HCl电离产生H+和Cl-,可判断HCl分子中存在离子键 |
| B、Na2O2固体中含有的阴离子与阳离子的个数比为1:1 |
| C、化学键是指使原子或离子相互结合的作用力 |
| D、不同元素组成的多原子分子中的化学键一定全是极性键 |
在温度和容积不变的密闭容器中,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图,则下列叙述正确的是( )

| A、该反应的化学方程式为A+3B?2C |
| B、在tls时,v(A)正=0 |
| C、(t1+l0)s时再充入0.4 molA和0.25 mol B,反应物A的转化率增大 |
| D、若该反应在绝热容器中进行,也在tl时刻达到平衡 |
 合成氨的原理为:N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol,该反应的能量变化如图所示.
合成氨的原理为:N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol,该反应的能量变化如图所示.