题目内容
关于化学键的叙述中,正确的是( )
| A、HCl电离产生H+和Cl-,可判断HCl分子中存在离子键 |
| B、Na2O2固体中含有的阴离子与阳离子的个数比为1:1 |
| C、化学键是指使原子或离子相互结合的作用力 |
| D、不同元素组成的多原子分子中的化学键一定全是极性键 |
考点:化学键
专题:化学键与晶体结构
分析:A.HCl中只存在共价键,属于共价化合物;
B.过氧化钠中阴阳离子个数比为1:2;
C.相邻原子之间强烈的相互作用称为化学键;
D不同元素组成的多原子分子中可能存在非极性键.
B.过氧化钠中阴阳离子个数比为1:2;
C.相邻原子之间强烈的相互作用称为化学键;
D不同元素组成的多原子分子中可能存在非极性键.
解答:
解:A.HCl中只存在共价键,属于共价化合物,在水分子的作用下电离出阴阳离子,故A错误;
B.过氧化钠中阴阳离子个数比为1:2,故B错误;
C.化学键是指使原子或离子相互结合的作用力,相互作用力包含吸引力和排斥力,故C正确;
D不同元素组成的多原子分子中可能存在非极性键,如:乙烯中含有非极性键,故D错误;
故选C.
B.过氧化钠中阴阳离子个数比为1:2,故B错误;
C.化学键是指使原子或离子相互结合的作用力,相互作用力包含吸引力和排斥力,故C正确;
D不同元素组成的多原子分子中可能存在非极性键,如:乙烯中含有非极性键,故D错误;
故选C.
点评:本题考查了化学键,明确物质的构成微粒及微粒间的作用力是解本题关键,注意过氧化钠中阴离子是过氧根离子而不是氧离子,为易错点.

练习册系列答案
相关题目
2008年11月18日国际著名血液学杂志《BLOOD》刊载了一条令人振奋的科研成果:中国科学家找到白血病致病元凶-蛋白质Shp-2.下列关于蛋白质Shp-2的说法正确的是( )
| A、它是纯净物 |
| B、在一定条件下能水解最终生成氨基酸 |
| C、天然蛋白质仅由碳、氢、氧、氮四种元素组成 |
| D、氨基酸和蛋白质shp-2都只能与碱反应 |
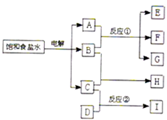 如图所示,每一方框中的字母各代表一种反应物或生成物:
如图所示,每一方框中的字母各代表一种反应物或生成物:物质A跟B反应生成物质E、F和G;物质C跟D在2L的反应容器中生成物质I,某温度下该反应起始时刻试剂的反应混合物组成如下表格所示,且D、I在常温下均为气体,
| C | D | I | |
| 起始组成/mol | 6 | 4 | 0 |
| 平衡组成/mol | 3 | 3 | 1 |
| A、物质H的化学式是HCl | ||
| B、反应①的化学方程式是Cl2+2NaOH═NaCl+NaClO+H2O | ||
C、反应②的平衡常数等于
| ||
| D、电解饱和食盐水的阴极可以是铁棒,阳极可以是碳棒或铁棒 |
甲酸的下列性质中,可以证明它是弱电解质的是( )
| A、1 mol?L-1甲酸溶液的pH约为2 |
| B、甲酸能与水以任意比例互溶 |
| C、10mL 1 mol?L-1甲酸恰好与10mL 1 mol?L-1NaOH溶液完全反应 |
| D、在相同条件下,甲酸溶液的导电性比醋酸溶液强 |
将0.2mol/L的醋酸钠溶液10mL与0.1mol/L盐酸10mL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是( )
| A、c(Na+)+c(H+)═c(CH3COO-)+c(OH-) |
| B、c(CH3COOH)>c(Cl-)>c(CH3COO-)>c(H+) |
| C、c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
| D、c(CH3COO-)═c(Cl-)═c(CH3COOH)>c(H+) |
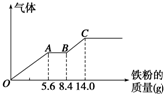 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )A、原混合酸中NO
| ||
| B、OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 | ||
| C、第二份溶液中最终溶质为FeSO4 | ||
| D、H2SO4浓度为1.25 mol?L-1 |