题目内容
在温度和容积不变的密闭容器中,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图,则下列叙述正确的是( )

| A、该反应的化学方程式为A+3B?2C |
| B、在tls时,v(A)正=0 |
| C、(t1+l0)s时再充入0.4 molA和0.25 mol B,反应物A的转化率增大 |
| D、若该反应在绝热容器中进行,也在tl时刻达到平衡 |
考点:化学平衡的影响因素,化学平衡建立的过程
专题:化学平衡专题
分析:A.0~t1 s内,浓度变化量之比等于反应速率之比,也等于化学计量数之比;
B.平衡时,正逆反应速率相等,但不等于0;
C、结合图象分析,利用平衡浓度计算平衡常数,结合浓度商和平衡常数比较分析判断反应进行方向判断;
D.绝热容器中,平衡体系温度变化平衡发生移动.
B.平衡时,正逆反应速率相等,但不等于0;
C、结合图象分析,利用平衡浓度计算平衡常数,结合浓度商和平衡常数比较分析判断反应进行方向判断;
D.绝热容器中,平衡体系温度变化平衡发生移动.
解答:
解:A、由图可知,A、B为反应物,C为生成物,化学计量数之比为(0.8-0.2):(0.5-0.3):(0.4-0)=3:1:2,该反应为3A+B?2C,故A错误;
B、在t1~(t1+10)s时,为平衡状态,v(正)=v(逆)≠0,故B错误;
C、反应为3A+B?2C,图象分析可知平衡常数=
=
=66.7,(t1+l0)s时再充入0.4 molA和0.25 mol B,Q=
=1.35<K,则平衡正向进行,反应物A的转化率增大,故C正确;
D、该反应在绝热容器中进行,反应过程中温度变化,平衡发生移动,在tl时刻未达到平衡,故D错误;
故选C.
B、在t1~(t1+10)s时,为平衡状态,v(正)=v(逆)≠0,故B错误;
C、反应为3A+B?2C,图象分析可知平衡常数=
| 0.42 |
| 0.23×0.3 |
| 200 |
| 3 |
| 0.42 |
| 0.63×0.55 |
D、该反应在绝热容器中进行,反应过程中温度变化,平衡发生移动,在tl时刻未达到平衡,故D错误;
故选C.
点评:本题考查物质的量和浓度随时间的变化曲线,把握图中线、面的含义及反应速率的计算、转化率的计算等即可解答,侧重学生分析能力及计算能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是( )
| A、稀硝酸 | B、稀盐酸 |
| C、硫酸铜溶液 | D、氢氧化钠溶液 |
甲酸的下列性质中,可以证明它是弱电解质的是( )
| A、1 mol?L-1甲酸溶液的pH约为2 |
| B、甲酸能与水以任意比例互溶 |
| C、10mL 1 mol?L-1甲酸恰好与10mL 1 mol?L-1NaOH溶液完全反应 |
| D、在相同条件下,甲酸溶液的导电性比醋酸溶液强 |
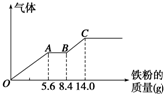 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )A、原混合酸中NO
| ||
| B、OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 | ||
| C、第二份溶液中最终溶质为FeSO4 | ||
| D、H2SO4浓度为1.25 mol?L-1 |
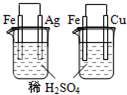
关于下列各装置的叙述中,错误的是( )
A、 可用于探究NH4HCO3的热稳定性 |
B、 可用于收集H2、CO2 |
C、 X若为CCl4,可用于吸收氨气或氯化氢,并能防倒吸 |
D、 可用于干燥、收集NH3,并吸收多余的氨气 |


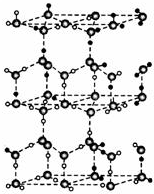 水分子间存在一种叫“氢键”的作用(介于范德华力与化学键之间)彼此结合而形成(H2O)n.在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体--冰.其结构示意如图所示.
水分子间存在一种叫“氢键”的作用(介于范德华力与化学键之间)彼此结合而形成(H2O)n.在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体--冰.其结构示意如图所示.