题目内容
 合成氨的原理为:N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol,该反应的能量变化如图所示.
合成氨的原理为:N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol,该反应的能量变化如图所示.(1)将1mol N2和3mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,放出的热量
(2)合成氨反应的平衡常数表达式为:K=
A.增加N2 B.升高温度 C.降低温度 D.增大压强 E.使用高效催化剂
(3)在恒温恒容条件下,向已达平衡状态的体系中充入He,容器内的压强增大,平衡
(4)将0.1mol N2和0.3mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的
| 7 |
| 8 |
A.向容器中按原比例再充入原料气 B.向容器中再充入一定量H2
C.向容器中再充入一定量的N2 D.改变反应的催化剂
E.液化生成物分离出氨.
考点:化学平衡的影响因素,反应热和焓变
专题:基本概念与基本理论
分析:(1)依据反应是可逆反应分析;
(2)平衡常数利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到;平衡常数随温度变化;
(3)恒温恒容容器中加入He气总压增大分压不变,平衡不动;
(4)根据化学平衡的三段式列式计算出氢气的转化率;根据影响化学平衡的条件分析判断以及增大一种物质的浓度会提高另一种物质的转化率.
(2)平衡常数利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到;平衡常数随温度变化;
(3)恒温恒容容器中加入He气总压增大分压不变,平衡不动;
(4)根据化学平衡的三段式列式计算出氢气的转化率;根据影响化学平衡的条件分析判断以及增大一种物质的浓度会提高另一种物质的转化率.
解答:
解:(1)当1mol N2和3mol H2完全反应时,才能放出92.4kJ的热量,但反应为可逆反应,不能完全进行,所以在一密闭容器中加入1molN2和3molH2,在一定条件下充分反应,放出的热量小于92.4kJ的热量,
故答案为:<;反应为可逆反应,不能完全进行,在一密闭容器中加入1molN2和3molH2,在一定条件下充分反应,放出的热量小于92.4kJ的热量;
(2)N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol,平衡常数K=
;措施能使K增大的因素是温度,平衡常数只随温度变化;
A.增加N2 不改变平衡常数,故A错误;
B.升高温度,平衡逆向进行,平衡常数减小,故B错误;
C.降低温度,平衡正向进行,平衡常数增大,故C正确;
D.增大压强不改变平衡常数,故D错误;
E.使用高效催化剂改变反应速率不改变化学平衡,平衡常数不变,故E错误;
故选C;
故答案为:
;C;
(3)在恒温恒容条件下,向已达平衡状态的体系中充入He,容器内的压强增大,气体分压不变,平衡不动;
故答案为:不;
(4)N2(g)+3H2(g)?2NH3(g)
起始量(mol) 0.3 0.5 0
变化量(mol) x 3x 2x
平衡量(mol) 0.3-x 0.5-3x 2x
容器内气体压强变为原来的
,即气体的物质的量变为为原来的
,则
=
,x=0.05,
H2的转化率为
×100%=30%,
N2(g)+3H2(g)?2NH3(g),反应是气体体积减小的放热反应,结合平衡移动原理分析判断
A、向容器中按原比例再充入原料气,相当于增大容器内的压强,平衡正向进行,提高氢气的转化率,故A正确;
B、向容器中再充入一定量H2,提高了N2的转化率,而本身的转化率降低,故B错误;
C、向容器中再充入一定量的N2,平衡正向进行,提高氢气转化率,故C正确;
D、改变反应的催化剂,不改变化学平衡,不能提高氢气转化率,故D错误;
E、液化生成物分离出氨,减少生成物,平衡正向进行,提高氢气转化率,故E正确;
故答案为:30%;ACE.
故答案为:<;反应为可逆反应,不能完全进行,在一密闭容器中加入1molN2和3molH2,在一定条件下充分反应,放出的热量小于92.4kJ的热量;
(2)N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol,平衡常数K=
| c2(NH3) |
| c(N2)c3(H2) |
A.增加N2 不改变平衡常数,故A错误;
B.升高温度,平衡逆向进行,平衡常数减小,故B错误;
C.降低温度,平衡正向进行,平衡常数增大,故C正确;
D.增大压强不改变平衡常数,故D错误;
E.使用高效催化剂改变反应速率不改变化学平衡,平衡常数不变,故E错误;
故选C;
故答案为:
| c2(NH3) |
| c(N2)c3(H2) |
(3)在恒温恒容条件下,向已达平衡状态的体系中充入He,容器内的压强增大,气体分压不变,平衡不动;
故答案为:不;
(4)N2(g)+3H2(g)?2NH3(g)
起始量(mol) 0.3 0.5 0
变化量(mol) x 3x 2x
平衡量(mol) 0.3-x 0.5-3x 2x
容器内气体压强变为原来的
| 7 |
| 8 |
| 7 |
| 8 |
| 0.3-x+0.5-3x+2x |
| 0.3+0.5 |
| 7 |
| 8 |
H2的转化率为
| 0.15mol |
| 0.5mol |
N2(g)+3H2(g)?2NH3(g),反应是气体体积减小的放热反应,结合平衡移动原理分析判断
A、向容器中按原比例再充入原料气,相当于增大容器内的压强,平衡正向进行,提高氢气的转化率,故A正确;
B、向容器中再充入一定量H2,提高了N2的转化率,而本身的转化率降低,故B错误;
C、向容器中再充入一定量的N2,平衡正向进行,提高氢气转化率,故C正确;
D、改变反应的催化剂,不改变化学平衡,不能提高氢气转化率,故D错误;
E、液化生成物分离出氨,减少生成物,平衡正向进行,提高氢气转化率,故E正确;
故答案为:30%;ACE.
点评:本题考查了化学平衡的三段式计算方法,影响平衡常数、化学反应速率、化学平衡的因素等应用,综合性较大,题目难度中等.

练习册系列答案
相关题目
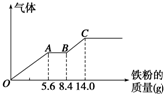 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )A、原混合酸中NO
| ||
| B、OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 | ||
| C、第二份溶液中最终溶质为FeSO4 | ||
| D、H2SO4浓度为1.25 mol?L-1 |
对于0.1mol/L NH4Cl溶液,下列说法正确的是( )
| A、1L该溶液中含有NH4+的物质的量为0.1 mol |
| B、通入少量HCl,c(NH4+)和c(Cl-)均增大 |
| C、c(NH4+)+c(OH-)=c(Cl-)+c(H+) |
| D、c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
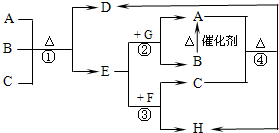 如图中每一字母表示一种反应物或生成物(反应时所需要的水或生成的水均已略去).已知D是一种盐,焰色反应呈紫色,E在常温下是黄绿色气体,F是一种能使品红溶液褪色的无色气体.
如图中每一字母表示一种反应物或生成物(反应时所需要的水或生成的水均已略去).已知D是一种盐,焰色反应呈紫色,E在常温下是黄绿色气体,F是一种能使品红溶液褪色的无色气体.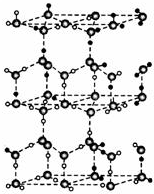 水分子间存在一种叫“氢键”的作用(介于范德华力与化学键之间)彼此结合而形成(H2O)n.在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体--冰.其结构示意如图所示.
水分子间存在一种叫“氢键”的作用(介于范德华力与化学键之间)彼此结合而形成(H2O)n.在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体--冰.其结构示意如图所示.