题目内容
16.某元素X的气态氢化物化学式为XH3,其最高价氧化物对应水化物化学式不可能是( )| A. | HXO3 | B. | H2XO4 | C. | H3XO4 | D. | H4X2O7 |
分析 元素X的气态氢化物化学式为XH3,可知X的最低价为-3价,则最高价为+5价,以此来解答.
解答 解:A.HXO3中X的化合价为+5价,如硝酸,故A不选;
B.H2XO4中X的化合价为+6价,故B选;
C.H3XO4中X的化合价为+5价,如磷酸,故C不选;
D.H4X2O7中X的化合价为+5价,故D不选;
故选B.
点评 本题考查元素的性质,为高频考点,把握最低价与最高价的绝对值之和为8为解答的关键,侧重分析与应用能力的考查,注意元素化合价的判断,题目难度不大.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
6.下列实验操作正确且能达到实验目的是( )
| A. | 在蒸发皿中加热胆矾晶体制无水硫酸铜 | |
| B. | 用向下排空气法收集NO2气体 | |
| C. | 用K3[Fe(CN)6]溶液检验FeCl2溶液中的Fe2+ | |
| D. | 将CO2与HCl混合气体通过碱石灰可得到纯净的CO2 |
7.下列离子方程式正确的是( )
| A. | 向Fe2(SO4)3溶液中加入铁粉:Fe3++Fe═2Fe3+ | |
| B. | 石灰石溶于醋酸:CaCO3+2CH3COOH═2CH3COO-+Ca2++CO2↑+H2O | |
| C. | 铜跟浓硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+═H2SiO3↓+2Na+ |
4.已知HF 酸性强于CH3COOH,常温下有下列三种溶液.有关叙述不正确的是( )
| 编号 | ① | ② | ③ |
| PH | 11 | 3 | 3 |
| 溶液 | NaOH溶液 | CH3COOH溶液 | HF溶液 |
| A. | CH3COOH稀溶液中加入少量CH3COONa,能使比值c(CH3COO-)/c(Na+)增大 | |
| B. | ①、②等体积很合后:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 向②加入NaF固体,CH3COOH电离平衡正向移动 | |
| D. | 中和相同体积的②、③,需消耗①的体积②<③ |
11. 可逆反应L(s )+aG(g)?bR(g)△H 达到平衡时、温度和压强对该反应的影响如图所示:x轴表示温度,y轴表示平衡混合气中G的体积分数,压强Pl>P2.下列判断正确的是( )
可逆反应L(s )+aG(g)?bR(g)△H 达到平衡时、温度和压强对该反应的影响如图所示:x轴表示温度,y轴表示平衡混合气中G的体积分数,压强Pl>P2.下列判断正确的是( )
 可逆反应L(s )+aG(g)?bR(g)△H 达到平衡时、温度和压强对该反应的影响如图所示:x轴表示温度,y轴表示平衡混合气中G的体积分数,压强Pl>P2.下列判断正确的是( )
可逆反应L(s )+aG(g)?bR(g)△H 达到平衡时、温度和压强对该反应的影响如图所示:x轴表示温度,y轴表示平衡混合气中G的体积分数,压强Pl>P2.下列判断正确的是( )| A. | 1+a<b | |
| B. | △H<0 | |
| C. | a>b | |
| D. | 增加L的物质的量,可提高G的转化率 |
1.升高温度,下列数据不一定增大的是( )
| A. | 化学反应速率v | B. | 弱电解质的电离度α | ||
| C. | 化学平衡常数K | D. | 水的离子积常数Kw |
8.埋在地下的钢管道可以用如图所示方法进行电化学保护.下列说法正确的是( )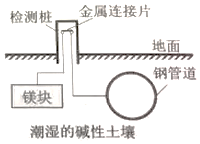

| A. | 该方法是将化学能转化成了电能 | |
| B. | 在此装置中钢管道做负极 | |
| C. | 该方法称为“外加电流阴极保护法” | |
| D. | 镁块上发生的电极反应:O2+2H2O+4e→4OH- |
5.分枝酸可用于生化研究,其结构简式如图.下列关于分枝酸的叙述正确的是( )
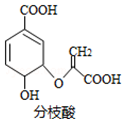

| A. | 分子中含有5种官能团 | |
| B. | 可与乙醇、乙酸反应,且反应类型相同 | |
| C. | 1mol分枝酸最多可与3molNaOH发生中和反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且反应类型相同 |
6.根据下列实验“操作和现象”,得出的结论正确的是( )
)
)
| 选项 | 操作和现象 | 结论 |
| A | 将表面附有黑色Ag2S的银器浸入盛有食盐水的铝质容器中,黑色逐渐褪去 | 银器为正极,Ag2S得电子生成单质银 |
| B | 测定相同浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 非金属性:S>C |
| C | 向NaAlO2溶液中滴入NaHCO3溶液,有白色沉淀生成 | AlO2-和HCO3-的水解反应相互促进 |
| D | 将Fe(NO3)2晶体溶于稀H2SO4后,滴加KSCN溶液,溶液变红 | Fe(NO3)2晶体已氧化变质 |
| A. | A | B. | B | C. | C | D. | D |