题目内容
1.升高温度,下列数据不一定增大的是( )| A. | 化学反应速率v | B. | 弱电解质的电离度α | ||
| C. | 化学平衡常数K | D. | 水的离子积常数Kw |
分析 A.升高温度,活化分子百分数增大;
B.弱电解质的电离吸热;
C.化学反应可能为吸热反应或放热反应;
D.水的电离吸热.
解答 解:A.升高温度,活化分子百分数增大,则化学反应速率加快,故A不选;
B.弱电解质的电离吸热,则升高温度,电离度增大,故B不选;
C.化学反应可能为吸热反应或放热反应,则升高温度,可增大或减小,故C选;
D.水的电离吸热,则升高温度,水的离子积常数Kw增大,故D不选;
故选C.
点评 本题考查化学平衡常数,为高频考点,把握电离、化学反应中能量变化与K的关系为解答的关键,侧重分析与应用能力的考查,注意K与温度有关,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列化学用语表示正确的是( )
| A. | HClO的结构式:H-Cl-O | B. | MgO的电子式:Mg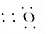 | ||
| C. | 四氯化碳分子比例模型: | D. | 聚四氟乙烯的结构简式: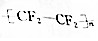 |
9.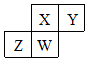 短周期元素X、Y、Z、W在元素周期表中的相对位置如表所示,W原子的质子数是其最外层电子数的三倍.下列说法不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如表所示,W原子的质子数是其最外层电子数的三倍.下列说法不正确的是( )
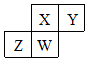 短周期元素X、Y、Z、W在元素周期表中的相对位置如表所示,W原子的质子数是其最外层电子数的三倍.下列说法不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如表所示,W原子的质子数是其最外层电子数的三倍.下列说法不正确的是( )| A. | 元素Y有同素异形体 | |
| B. | 最高价氧化物对应水化物的酸性:X>Z | |
| C. | 简单气态氢化物的热稳定性:Y>Z | |
| D. | 原于半径:W>Z>Y>X |
16.某元素X的气态氢化物化学式为XH3,其最高价氧化物对应水化物化学式不可能是( )
| A. | HXO3 | B. | H2XO4 | C. | H3XO4 | D. | H4X2O7 |
6.目前科学家们已经合成许多硫-氮化合物,其中一种结构如图所示.关于该物质说法正确的是( )

| A. | 该物质的分子式为SN | |
| B. | 该物质熔、沸点较低 | |
| C. | 该物质分子中所有原子的最外层均达到稳定结构 | |
| D. | 该物质与化合物S2N2互为同素异形体 |
10.化学在生产和日常生活中有着重要作用,下列有关说法不正确的是( )
| A. | 硅酸钠的水溶液俗称水玻璃,可用作木材防火剂 | |
| B. | “地沟油”禁止食用,但可以用来制肥皂 | |
| C. | 用聚乙烯塑料代替聚乳酸塑料可减少白色污染 | |
| D. | 利用粮食酿酒经过了淀粉→葡糖糖→乙醇的化学变化过程 |
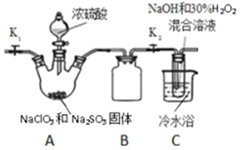 亚氯酸钠(NaClO2)和ClO2都是重要的漂白剂.通常情况下,ClO2是一种具有强氧化性的黄色气体,常用于水的净化和纸浆、纺织品的漂白.ClO2易发生爆炸,在生产、使用时可用其它气体进行稀释.ClO2易与碱反应生成亚氯酸盐和氯酸盐.
亚氯酸钠(NaClO2)和ClO2都是重要的漂白剂.通常情况下,ClO2是一种具有强氧化性的黄色气体,常用于水的净化和纸浆、纺织品的漂白.ClO2易发生爆炸,在生产、使用时可用其它气体进行稀释.ClO2易与碱反应生成亚氯酸盐和氯酸盐.