题目内容
4.已知HF 酸性强于CH3COOH,常温下有下列三种溶液.有关叙述不正确的是( )| 编号 | ① | ② | ③ |
| PH | 11 | 3 | 3 |
| 溶液 | NaOH溶液 | CH3COOH溶液 | HF溶液 |
| A. | CH3COOH稀溶液中加入少量CH3COONa,能使比值c(CH3COO-)/c(Na+)增大 | |
| B. | ①、②等体积很合后:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 向②加入NaF固体,CH3COOH电离平衡正向移动 | |
| D. | 中和相同体积的②、③,需消耗①的体积②<③ |
分析 A.CH3COOH稀溶液中存在电离平衡CH3COOH?CH3COO-+H+,加入少量CH3COONa,醋酸根离子浓度增大;
B.氢氧化钠是强电解质,醋酸是弱电解质,常温下,pH=11的氢氧化钠溶液浓度小于pH=3的醋酸溶液,二者等体积混合时,醋酸过量导致溶液呈酸性,再结合电荷守恒判断;
C.氟化钠是强碱弱酸盐,其溶液呈碱性,向醋酸中加入氟化钠促进醋酸电离;
D.相同温度下,HF酸性强于CH3COOH,则HF的电离程度大于CH3COOH,则pH相等的两种溶液中HF浓度大于CH3COOH,中和酸需要氢氧化钠的体积与酸的物质的量成正比.
解答 解:A.CH3COOH稀溶液中存在电离平衡CH3COOH?CH3COO-+H+,加入少量CH3COONa,醋酸根离子浓度增大$\frac{c(C{H}_{3}CO{O}^{-})}{c(N{a}^{+})}$比值增大,故A正确;
B.氢氧化钠是强电解质,醋酸是弱电解质,常温下,pH=11的氢氧化钠溶液浓度小于pH=3的醋酸溶液,二者等体积混合时,醋酸过量导致溶液呈酸性,则c(H+)>c(OH-),溶液中存在电荷守恒,根据电荷守恒得c(CH3COO-)+c(OH-)=c(Na+)+c(H+),所以c(CH3COO-)>c(Na+),酸的电离程度较小,所以c(Na+)>c(H+),则混合溶液中离子浓度大小顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B正确;
C.氟化钠是强碱弱酸盐,其溶液呈碱性,向醋酸中加入氟化钠促进醋酸电离,则醋酸电离平衡向正反应方向移动,故C正确;
D.相同温度下,HF酸性强于CH3COOH,则HF的电离程度大于CH3COOH,则pH相等的两种溶液中HF浓度大于CH3COOH,中和酸需要氢氧化钠的体积与酸的物质的量成正比,pH相等、体积相等的HF和醋酸溶液中,醋酸的物质的量大于HF,所以中和相同体积的②、③,需消耗①的体积②>③,故D错误;
故选D.
点评 本题考查了弱电解质的电离,明确“相同浓度的不同弱酸溶液中,酸的酸性强弱与其pH的关系”是解本题关键,再结合电荷守恒、物质之间的反应来分析解答即可,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | C2H2 | B. | C3H6 | C. | C4H10 | D. | C6H6 |
| A. | 标准状况下,11.2LC2H5OH含有的氢原子数为3NA | |
| B. | 25℃时,1LpH=12的碳酸钠溶液中含有Na+的数目为0.02NA | |
| C. | 过氧化钠与水反应时,生成0.5molO2转移的电子数为NA | |
| D. | 2molSO2和1molO2在一定条件下充分反应,所得混合气体的分子数等于2NA |
(1)氧化还原法消除NOx的转化如下:NO$→_{反应Ⅰ}^{O_{3}}$NO2$→_{反应Ⅱ}^{CO(NH_{2})_{2}}$N2
已知:NO(g)+O3(g)═NO2(g)+O2(g)△H=-200.9kJ/mol
2NO(g)+O2(g)═2NO(g)△H=-116.2kJ/mol
则反应I的热化学方程式为3NO(g)+O3(g)═3NO2(g)△H=-317.1 kJ•mol-1.
(2)有人设想将CO按下列反应除去:2CO(g)═2C(s)+O2(g)△H>0,请你分析该设想能否实现?否(填“是”或“否”),依据是该反应是焓增、熵减的反应,根据G=△H-T•△S,G>0.
(3)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠.已知常温时,甲酸的电离平衡常数Ka=1.70×10-4.
①甲酸钠的水溶液呈碱性,请用离子反应方程式表示其原因HCOO-+H2O?HCOOH+OH-.
②向20mL 0.1mol/L的甲酸钠溶液中滴加10ml 0.1mol/L的盐酸,混合液呈酸性(填“酸”或“碱”),溶液中离子浓度从大到小的顺序为c(Na+)>c(HCOO-)>c(Cl-)>c(H+)>c(OH-).
(4)活性炭也可用于处理汽车尾气中的NO.在2L恒容密闭容器中加入0.1000molNO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如表:
| 固体活性炭/mol | NO/mol | A/mol | B/mol | |
| 200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 |
| 335℃ | 2.005 | 0.0500 | 0.0250 | 0.0250 |
②200℃时,平衡后向恒容容器中再充入0.1molNO,再次平衡后,NO的百分含量将不变.(填“增大”、“减小”或“不变”).
③计算反应体系在335℃时的平衡常数0.25.
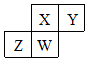 短周期元素X、Y、Z、W在元素周期表中的相对位置如表所示,W原子的质子数是其最外层电子数的三倍.下列说法不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如表所示,W原子的质子数是其最外层电子数的三倍.下列说法不正确的是( )| A. | 元素Y有同素异形体 | |
| B. | 最高价氧化物对应水化物的酸性:X>Z | |
| C. | 简单气态氢化物的热稳定性:Y>Z | |
| D. | 原于半径:W>Z>Y>X |
| A. | HXO3 | B. | H2XO4 | C. | H3XO4 | D. | H4X2O7 |
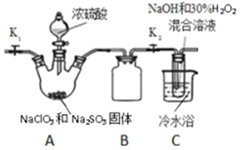 亚氯酸钠(NaClO2)和ClO2都是重要的漂白剂.通常情况下,ClO2是一种具有强氧化性的黄色气体,常用于水的净化和纸浆、纺织品的漂白.ClO2易发生爆炸,在生产、使用时可用其它气体进行稀释.ClO2易与碱反应生成亚氯酸盐和氯酸盐.
亚氯酸钠(NaClO2)和ClO2都是重要的漂白剂.通常情况下,ClO2是一种具有强氧化性的黄色气体,常用于水的净化和纸浆、纺织品的漂白.ClO2易发生爆炸,在生产、使用时可用其它气体进行稀释.ClO2易与碱反应生成亚氯酸盐和氯酸盐.