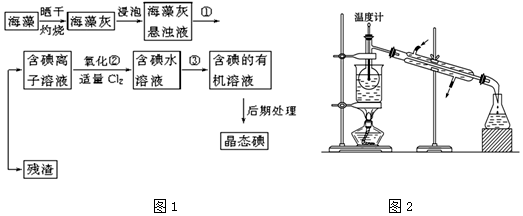
题目内容
6.下列实验操作正确且能达到实验目的是( )| A. | 在蒸发皿中加热胆矾晶体制无水硫酸铜 | |
| B. | 用向下排空气法收集NO2气体 | |
| C. | 用K3[Fe(CN)6]溶液检验FeCl2溶液中的Fe2+ | |
| D. | 将CO2与HCl混合气体通过碱石灰可得到纯净的CO2 |
分析 A.应在坩埚中加热固体;
B.NO2密度比空气大;
C.K3[Fe(CN)6]与亚铁离子反应生成蓝色沉淀;
D.二者都与碱石灰反应.
解答 解:A.为防止固体迸溅,应在坩埚中加热固体,加热液体用蒸发皿,故A错误;
B.NO2密度比空气大,应用向上排空法收集,故B错误;
C.K3[Fe(CN)6]与亚铁离子反应生成蓝色沉淀,可用于鉴别,故C正确;
D.二者都与碱石灰反应,可有哪个饱和碳酸氢钠溶液除杂,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高考常见题型和高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同以及实验的可行性和合理性的评价,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7. 电解质溶液的电导率越大,导电能力越强.室温下,pH均为1的一元强酸HA和一元弱酸HB各1mL,分别加水稀释.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
电解质溶液的电导率越大,导电能力越强.室温下,pH均为1的一元强酸HA和一元弱酸HB各1mL,分别加水稀释.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
 电解质溶液的电导率越大,导电能力越强.室温下,pH均为1的一元强酸HA和一元弱酸HB各1mL,分别加水稀释.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
电解质溶液的电导率越大,导电能力越强.室温下,pH均为1的一元强酸HA和一元弱酸HB各1mL,分别加水稀释.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )| A. | 曲线I代表HA的稀释过程 | |
| B. | a溶液的导电性比b溶液的导电性强 | |
| C. | 中和a溶液消耗0.1mol/L氢氧化钠溶液的体积为V1,中和c溶液消耗0.1mol/L氢氧化钠溶液的体积为V2,则V1>V2 | |
| D. | 将a、b两溶液加热至30℃,$\frac{C({A}^{-})}{C({B}^{-})}$变小 |
8.在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列物质参与反应的先后顺序正确的是( )
| A. | 含等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+ | |
| B. | 含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Cu2+、Fe3+、H+、Fe2+ | |
| C. | 含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:OH-、AlO2-、CO32- | |
| D. | 含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2:KOH、Ba(OH)2、K2CO3、BaCO3 |
14.相同质量的下列烃,在空气中充分燃烧产生二氧化碳最少的是( )
| A. | C2H2 | B. | C3H6 | C. | C4H10 | D. | C6H6 |
11.下列化学用语表示正确的是( )
| A. | HClO的结构式:H-Cl-O | B. | MgO的电子式:Mg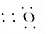 | ||
| C. | 四氯化碳分子比例模型: | D. | 聚四氟乙烯的结构简式: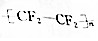 |
15.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2LC2H5OH含有的氢原子数为3NA | |
| B. | 25℃时,1LpH=12的碳酸钠溶液中含有Na+的数目为0.02NA | |
| C. | 过氧化钠与水反应时,生成0.5molO2转移的电子数为NA | |
| D. | 2molSO2和1molO2在一定条件下充分反应,所得混合气体的分子数等于2NA |
16.某元素X的气态氢化物化学式为XH3,其最高价氧化物对应水化物化学式不可能是( )
| A. | HXO3 | B. | H2XO4 | C. | H3XO4 | D. | H4X2O7 |