题目内容
8.埋在地下的钢管道可以用如图所示方法进行电化学保护.下列说法正确的是( )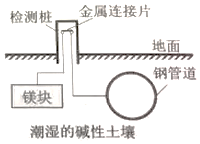
| A. | 该方法是将化学能转化成了电能 | |
| B. | 在此装置中钢管道做负极 | |
| C. | 该方法称为“外加电流阴极保护法” | |
| D. | 镁块上发生的电极反应:O2+2H2O+4e→4OH- |
分析 根据图片知,该金属防护措施采用的是牺牲阳极的阴极保护法,即把金属和钢管、及电解质溶液构成原电池,镁块作负极,钢管道作正极,从而钢管道得到保护.
解答 解:A.构成的原电池中,该方法是将化学能转化成了电能,故A正确;
B.根据图片知,该金属防护措施采用的是牺牲阳极的阴极保护法,钢管道作正极,故B错误;
C.根据图片知,该金属防护措施采用的是牺牲阳极的阴极保护法,故C错误;
D.镁块作负极,电极反应:Mg-2e-+4OH-=Mg(OH)2↓,故D错误;
故选:A.
点评 本题考查金属的腐蚀与防护,明确金属腐蚀与防护的原理即可解答,难度不大.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
19.研究碳、氮及其化合物的转化对于环境的改善有重大意义.
(1)氧化还原法消除NOx的转化如下:NO$→_{反应Ⅰ}^{O_{3}}$NO2$→_{反应Ⅱ}^{CO(NH_{2})_{2}}$N2
已知:NO(g)+O3(g)═NO2(g)+O2(g)△H=-200.9kJ/mol
2NO(g)+O2(g)═2NO(g)△H=-116.2kJ/mol
则反应I的热化学方程式为3NO(g)+O3(g)═3NO2(g)△H=-317.1 kJ•mol-1.
(2)有人设想将CO按下列反应除去:2CO(g)═2C(s)+O2(g)△H>0,请你分析该设想能否实现?否(填“是”或“否”),依据是该反应是焓增、熵减的反应,根据G=△H-T•△S,G>0.
(3)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠.已知常温时,甲酸的电离平衡常数Ka=1.70×10-4.
①甲酸钠的水溶液呈碱性,请用离子反应方程式表示其原因HCOO-+H2O?HCOOH+OH-.
②向20mL 0.1mol/L的甲酸钠溶液中滴加10ml 0.1mol/L的盐酸,混合液呈酸性(填“酸”或“碱”),溶液中离子浓度从大到小的顺序为c(Na+)>c(HCOO-)>c(Cl-)>c(H+)>c(OH-).
(4)活性炭也可用于处理汽车尾气中的NO.在2L恒容密闭容器中加入0.1000molNO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如表:
①该反应的正反应为放热(填”吸热”或“放热”)反应.
②200℃时,平衡后向恒容容器中再充入0.1molNO,再次平衡后,NO的百分含量将不变.(填“增大”、“减小”或“不变”).
③计算反应体系在335℃时的平衡常数0.25.
(1)氧化还原法消除NOx的转化如下:NO$→_{反应Ⅰ}^{O_{3}}$NO2$→_{反应Ⅱ}^{CO(NH_{2})_{2}}$N2
已知:NO(g)+O3(g)═NO2(g)+O2(g)△H=-200.9kJ/mol
2NO(g)+O2(g)═2NO(g)△H=-116.2kJ/mol
则反应I的热化学方程式为3NO(g)+O3(g)═3NO2(g)△H=-317.1 kJ•mol-1.
(2)有人设想将CO按下列反应除去:2CO(g)═2C(s)+O2(g)△H>0,请你分析该设想能否实现?否(填“是”或“否”),依据是该反应是焓增、熵减的反应,根据G=△H-T•△S,G>0.
(3)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠.已知常温时,甲酸的电离平衡常数Ka=1.70×10-4.
①甲酸钠的水溶液呈碱性,请用离子反应方程式表示其原因HCOO-+H2O?HCOOH+OH-.
②向20mL 0.1mol/L的甲酸钠溶液中滴加10ml 0.1mol/L的盐酸,混合液呈酸性(填“酸”或“碱”),溶液中离子浓度从大到小的顺序为c(Na+)>c(HCOO-)>c(Cl-)>c(H+)>c(OH-).
(4)活性炭也可用于处理汽车尾气中的NO.在2L恒容密闭容器中加入0.1000molNO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如表:
| 固体活性炭/mol | NO/mol | A/mol | B/mol | |
| 200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 |
| 335℃ | 2.005 | 0.0500 | 0.0250 | 0.0250 |
②200℃时,平衡后向恒容容器中再充入0.1molNO,再次平衡后,NO的百分含量将不变.(填“增大”、“减小”或“不变”).
③计算反应体系在335℃时的平衡常数0.25.
16.某元素X的气态氢化物化学式为XH3,其最高价氧化物对应水化物化学式不可能是( )
| A. | HXO3 | B. | H2XO4 | C. | H3XO4 | D. | H4X2O7 |
3.下列四个反应(条件略,已配平),酸所体现的性质与其他三者有所不同的是( )
| A. | MnO2+4HCl(浓)→MnCl2+Cl2↑+2H2O | |
| B. | Ag+2HNO3(浓)→AgNO3+NO2↑+H2O | |
| C. | C+2H2SO4(浓)→CO2↑+2SO2↑+2H2O | |
| D. | 3Fe3O4+28HNO3(浓)→9Fe(NO3)3+NO↑+14H2O |
20.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 0.2 mol的铁与足量的稀硝酸反应,生成气体的分子数目为0.3 NA | |
| B. | 常温常压下,14 g由 C2H4、C3H6组成的混合气体中含有碳原子的数目为NA | |
| C. | 2.24 L CO2与足量的Na2O2反应,转移的电子总数必为0.1NA | |
| D. | l Ll mol/L的KAl(SO4)2溶液中阳离子总数为2 NA |
17.有关胶体与溶液的说法正确的是( )
| A. | 胶体粒子带电,溶液溶质粒子不带电 | |
| B. | 渗析实验可以鉴别胶体和溶液 | |
| C. | 胶体与溶液都可以通过滤纸、半透膜和分子筛 | |
| D. | 丁达尔效应可以区分胶体和溶液 |
7.CO2可用于合成二甲醚(CH3OCH3),有关反应的热化学方程式如下:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,
2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1,
则CO2与H2反应合成二甲醚的热化学方程式正确的是( )
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,
2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1,
则CO2与H2反应合成二甲醚的热化学方程式正确的是( )
| A. | 2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=-121.5kJ•mol-1 | |
| B. | 2CO2(g)+3H2(g)═$\frac{1}{2}$CH3OCH3(g)+$\frac{3}{2}$H2O(g)△H=-25.5kJ•mol-1 | |
| C. | 2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=+121.5kJ•mol-1 | |
| D. | 2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=-72.5kJ•mol-1. |