题目内容
9.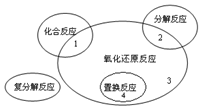 (1)氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是D
(1)氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是DA.Cl2+2KBr═Br2+2KCl
B.2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O═4Fe(OH)3
D.CH4+2O2?CO2+2H2O
(2)高锰酸钾和氢溴酸溶液可以发生如下反应:
2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O
①其中还原剂HBr,还原产物是MnBr2.
②若消耗0.1mol氧化剂,则被氧化的还原剂的物质的量为0.5mol,转移电子的物质的量是0.5mol.
分析 (1)由图可知,区域3的反应不属于化合反应,不属于分解反应,不属于置换反应,但一定属于氧化还原反应,以此来解答;
(2)反应2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O中,Br元素化合价升高,Mn元素化合价降低,则反应中KMnO4为氧化剂,HBr为还原剂,根据方程式计算.
解答 解:(1)A.Cl2+2KBr═Br2+2KCl属于置换反应,不符合,故A不选;
B.2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑属于分解反应,不符合,故B不选;
C.4Fe(OH)2+O2+2H2O═4Fe(OH)3属于化合反应,不符合,故C不选;
D.CH4+2O2?CO2+2H2O不属于化合反应,不属于分解反应,不是置换反应,属于氧化还原反应,符合,故D选;
故选D;
(2)①反应2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O中,Br元素化合价升高1价,Mn元素化合价降低5价,反应中转移10个电子,反应中KMnO4为氧化剂,MnBr2为还原产物,HBr为还原剂,Br2为氧化产物,故答案为:HBr;MnBr2;
②若消耗0.1mol氧化剂,则被氧化的还原剂,即发生化合价变化的HBr的物质的量为0.5mol;转移的电子的物质的量为0.5mol,故答案为:0.5mol;0.5mol.
点评 本题考查氧化还原反应的综合应用,题目难度中等,注意从化合价的角度分析,计算时注意氧化还原反应中氧化剂和还原剂之间得失电子数目相等,表现为化合价升降总数相等.

练习册系列答案
相关题目
17.下列反应的离子方程式书写中,正确的是( )
| A. | 小苏打溶液中加入NaOH溶液:H ++OH-=H2O | |
| B. | 氧化铁与稀盐酸反应:FeO+2H+=Fe2++H2O | |
| C. | 硫酸铜溶液与氢氧化钡溶液混合:Cu2++2OH-=Cu(OH)2↓ | |
| D. | 氯化钡与纯碱溶液反应:Ba2++CO32-=BaCO3↓ |
14.从2006年1月1日起,江苏省徐州、连云港、淮安、盐城、宿迁等苏北五市已全面推广使用车用乙醇汽油.下列各说法中正确的是( )
| A. | 乙醇汽油是纯净物,汽油是混合物 | |
| B. | 推广使用乙醇汽油是为了减少温室气体排放 | |
| C. | 推广使用乙醇汽油是为了减少化石燃料消耗 | |
| D. | 用粮食生产乙醇是开发新能源的发展方向 |
1.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
| A. | NaOH(s) | B. | CH3COONa(s) | C. | NH4Cl(s) | D. | Na2CO3(s) |
18.将5.10g镁铝合金加入120mL4.0mol•L-1的盐酸中,待合金完全溶解后,得到溶液X.下列说法一定正确的是( )
| A. | 合金完全溶解后产生的H2的物质的量为0.24mol | |
| B. | 合金中的镁与铝的物质的量之比小于1 | |
| C. | 若向溶液X中加入270mL2.0mol•L-1NaOH溶液,充分反应,所得沉淀为Mg(OH)2 | |
| D. | 若向溶液X中加入足量的氨水,充分反应,所得沉淀经过过滤、洗涤后充分灼烧,则残留固体质量大于8.50g |