题目内容
17.下列反应的离子方程式书写中,正确的是( )| A. | 小苏打溶液中加入NaOH溶液:H ++OH-=H2O | |
| B. | 氧化铁与稀盐酸反应:FeO+2H+=Fe2++H2O | |
| C. | 硫酸铜溶液与氢氧化钡溶液混合:Cu2++2OH-=Cu(OH)2↓ | |
| D. | 氯化钡与纯碱溶液反应:Ba2++CO32-=BaCO3↓ |
分析 A.小苏打为碳酸氢钠,碳酸氢根离子不能拆开;
B.氧化铁为三氧化二铁,不是氧化亚铁;
C.漏掉了钡离子与硫酸根离子生成硫酸钡的反应;
D.氯化钡与碳酸钠反应生成碳酸钡沉淀和氯化钠.
解答 解:A.小苏打溶液中加入NaOH溶液,二者反应生成碳酸钠和水,正确的离子方程式为:HCO3-+OH-=H2O+CO32-,故A错误;
B.氧化铁与稀盐酸反应生成氯化铁和水,正确的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,故B错误;
C.硫酸铜与氢氧化钡溶液反应生成硫酸钡、氢氧化铜沉淀,正确的离子方程式为:SO42-+Ba2++Cu2++2OH-=Cu(OH)2↓+BaSO4↓,故C错误;
D.氯化钡与纯碱溶液反应的离子方程式为:Ba2++CO32-=BaCO3↓,故D正确;
故选D.
点评 本题考查了离子方程式的正误判断,题目难度不大,注意掌握离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
8.下列电离方程式中,正确的是( )
| A. | H2SO4=H2++SO42- | B. | Ba(OH)2=Ba2++OH - | ||
| C. | NaNO3=Na ++NO3- | D. | CuSO4=Cu+2+SO4-2 |
5. 中和滴定的相关问题
中和滴定的相关问题
Ⅰ.下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)无“0”刻度的是ab(填字母).
(2)下列操作合理的是AD(填字母).
A.用25mL碱式滴定管量取20.00mL NaOH溶液
B.用托盘天平准确称量10.20g碳酸钠固体
C.用100mL量筒量取3.2mL浓硫酸
D.用500mL容量瓶配制1mol•L-1的氢氧化钠溶液495.5mL
Ⅱ.某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答下列问题:
(1)以上步骤有错误的是①(填编号).
(2)判断滴定终点的现象是:滴入最后一滴NaOH溶液时,溶液刚好由无色变为浅红色,且半分钟内不变色.
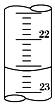
(3)如图是某次滴定时的滴定管中的液面,其读数为22.60mL.
(4)根据下列数据,请计算待测盐酸的浓度:0.2000mol•L-1.
(5)在上述实验中,下列操作(其它操作正确)一定会造成测定结果偏高的是ACD(填字母).
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液.
 中和滴定的相关问题
中和滴定的相关问题Ⅰ.下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)无“0”刻度的是ab(填字母).
(2)下列操作合理的是AD(填字母).
A.用25mL碱式滴定管量取20.00mL NaOH溶液
B.用托盘天平准确称量10.20g碳酸钠固体
C.用100mL量筒量取3.2mL浓硫酸
D.用500mL容量瓶配制1mol•L-1的氢氧化钠溶液495.5mL
Ⅱ.某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答下列问题:
(1)以上步骤有错误的是①(填编号).
(2)判断滴定终点的现象是:滴入最后一滴NaOH溶液时,溶液刚好由无色变为浅红色,且半分钟内不变色.
(3)如图是某次滴定时的滴定管中的液面,其读数为22.60mL.
(4)根据下列数据,请计算待测盐酸的浓度:0.2000mol•L-1.
| 滴定次数 | 待测体积(mL) | 标准烧碱溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.00 |
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液.
12.下列说法正确的是( )
| A. | 分子式为C7H8O且含苯环的有机化合物有4种 | |
| B. | 乙醇能使酸性高锰酸钾溶液褪色 | |
| C. | 由溴丙烷水解制丙醇和由丙烯与水反应制丙醇反应类型相同 | |
| D. | 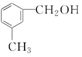 遇FeCl3溶液可显紫色 遇FeCl3溶液可显紫色 |
6.下列关于胶体和溶液的说法正确的是( )
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在1~100 nm之间 | |
| B. | 溶液呈电中性,胶体带有电荷 | |
| C. | 溶液中分散质微粒能透过滤纸,胶体中分散质微粒不能透过滤纸 | |
| D. | 制备氢氧化铁胶体时,可以将饱和FeCl3溶液滴入沸水,然后长时间煮沸 |
17.36.5g HCl溶解在1L水中(水的密度近似为1g•mL-1)所得溶液的密度为ρ g•mL-1,质量分数为w,物质的量浓度为c mol•L-1,NA表示阿伏加德罗常数的数值,则下列叙述中正确的是( )
| A. | 所得溶液的物质的量浓度为1 mol.L-1 | |
| B. | 所得溶液中含有NA个HCl分子 | |
| C. | 36.5 g HCl气体占有的体积为22.4 L | |
| D. | 所得溶液的质量分数:w=$\frac{36.5c}{1000ρ}$ |
 ;Y的价电子轨道表示式为
;Y的价电子轨道表示式为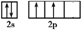 .
.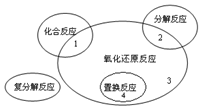 (1)氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是D
(1)氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是D