题目内容
9.按要求写出下列方程式(1)Fe2(SO4)3(写出电离方程式)Fe2(SO4)3═2Fe3++3SO42-
(2)Ba(OH)2和H2SO4溶液:(写出化学方程式)Ba(OH)2+H2SO4═2H2O+BaSO4↑.
分析 (1)硫酸铁为强电解质,完全电离出三价铁离子与硫酸根离子;
(2)二者反应生成硫酸钡沉淀和氢氧化铜沉淀.
解答 解:(1)硫酸铁为强电解质,完全电离出三价铁离子与硫酸根离子,电离方程式:Fe2(SO4)3═2Fe3++3SO42-;
故答案为:Fe2(SO4)3═2Fe3++3SO42-;
(2)Ba(OH)2和H2SO4溶液,二者反应生成硫酸钡沉淀和氢氧化铜沉淀,化学方程式:Ba(OH)2+H2SO4═2H2O+BaSO4↓;
故答案为:Ba(OH)2+H2SO4═2H2O+BaSO4↓.
点评 本题考查了电解质电离方程式、离子反应方程式的书写,明确电解质的强弱及电离方式、熟悉离子方程式书写方法是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 11.2 L一氧化碳中含有的分子数等于0.5NA | |
| B. | 1mol FeCl3制得的氢氧化铁胶体中含胶粒数为NA | |
| C. | 32g臭氧所含电子数目为16NA | |
| D. | 0.5L 2mol/L盐酸中含有的HCl分子数为NA |
17.36.5g HCl溶解在1L水中(水的密度近似为1g•mL-1)所得溶液的密度为ρ g•mL-1,质量分数为w,物质的量浓度为c mol•L-1,NA表示阿伏加德罗常数的数值,则下列叙述中正确的是( )
| A. | 所得溶液的物质的量浓度为1 mol.L-1 | |
| B. | 所得溶液中含有NA个HCl分子 | |
| C. | 36.5 g HCl气体占有的体积为22.4 L | |
| D. | 所得溶液的质量分数:w=$\frac{36.5c}{1000ρ}$ |
14.已知温度T时,水的离子积常数为Kw,该温度下,将浓度为a mol•L-1的一元酸HA溶液与b mol•L-1的一元碱BOH溶液等体积混合,可判断该溶液一定呈中性的依据是( )
| A. | 混合溶液的PH=7 | B. | 混合溶液中,C(H+)=$\sqrt{Kw}$mol•L-1 | ||
| C. | a=b | D. | 混合溶液中,C(H+)+C(B+)=C(OH-)+C(A-) |
18.下列说法中正确的是( )
| A. | 生理盐水指质量分数为0.9%的NaCl溶液 | |
| B. | 1L 0.2mol/L硫酸铁溶液中含有的SO42-的离子数为0.2NA | |
| C. | 1L 1 mol/L K2CO3溶液中含有的钾离子数目为NA | |
| D. | 0.1 mol/L BaCl2溶液中,Cl-的物质的量浓度为0.1 mol/L |
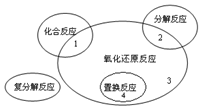 (1)氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是D
(1)氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是D