题目内容
14.从2006年1月1日起,江苏省徐州、连云港、淮安、盐城、宿迁等苏北五市已全面推广使用车用乙醇汽油.下列各说法中正确的是( )| A. | 乙醇汽油是纯净物,汽油是混合物 | |
| B. | 推广使用乙醇汽油是为了减少温室气体排放 | |
| C. | 推广使用乙醇汽油是为了减少化石燃料消耗 | |
| D. | 用粮食生产乙醇是开发新能源的发展方向 |
分析 A、乙醇汽油是乙醇和普通汽油的混合物;
B、乙醇和汽油燃烧均能生成二氧化碳;
C、汽油是由石油分馏得到,不可再生,而乙醇可以再生;
D、用粮食生产乙醇会造成粮食的浪费.
解答 解:A、汽油本身即混合物,而乙醇汽油是乙醇和普通汽油的混合物,故A错误;
B、乙醇和汽油燃烧均能生成二氧化碳,故推广乙醇汽油不能减少温室气体的排放,故B错误;
C、汽油是由石油分馏得到,石油是化石燃料不可再生,故汽油不可再生,而乙醇可以再生,故推广乙醇汽油可以减少化石燃料的消耗,故C正确;
D、粮食是一个国家重要的资源,是百姓的根本,用粮食生产乙醇会造成粮食的浪费,应该用植物的秸秆来生产,故D错误.
故选C.
点评 本题考查了新能源---乙醇汽油,但应意识到,乙醇汽油只能在某种程度上减少化石能源的消耗,但不能从根本上解决燃料的燃烧对环境的污染问题.

练习册系列答案
相关题目
4.NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 25℃,1.01×105Pa,11.2L Cl2含有的分子数小于0.5NA | |
| B. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为1NA | |
| C. | 1molFeCl3与沸水反应生成NA个Fe(OH)3胶粒 | |
| D. | 常温下,23 g NO2含有2NA个氧原子 |
5. 中和滴定的相关问题
中和滴定的相关问题
Ⅰ.下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)无“0”刻度的是ab(填字母).
(2)下列操作合理的是AD(填字母).
A.用25mL碱式滴定管量取20.00mL NaOH溶液
B.用托盘天平准确称量10.20g碳酸钠固体
C.用100mL量筒量取3.2mL浓硫酸
D.用500mL容量瓶配制1mol•L-1的氢氧化钠溶液495.5mL
Ⅱ.某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答下列问题:
(1)以上步骤有错误的是①(填编号).
(2)判断滴定终点的现象是:滴入最后一滴NaOH溶液时,溶液刚好由无色变为浅红色,且半分钟内不变色.
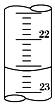
(3)如图是某次滴定时的滴定管中的液面,其读数为22.60mL.
(4)根据下列数据,请计算待测盐酸的浓度:0.2000mol•L-1.
(5)在上述实验中,下列操作(其它操作正确)一定会造成测定结果偏高的是ACD(填字母).
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液.
 中和滴定的相关问题
中和滴定的相关问题Ⅰ.下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)无“0”刻度的是ab(填字母).
(2)下列操作合理的是AD(填字母).
A.用25mL碱式滴定管量取20.00mL NaOH溶液
B.用托盘天平准确称量10.20g碳酸钠固体
C.用100mL量筒量取3.2mL浓硫酸
D.用500mL容量瓶配制1mol•L-1的氢氧化钠溶液495.5mL
Ⅱ.某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答下列问题:
(1)以上步骤有错误的是①(填编号).
(2)判断滴定终点的现象是:滴入最后一滴NaOH溶液时,溶液刚好由无色变为浅红色,且半分钟内不变色.
(3)如图是某次滴定时的滴定管中的液面,其读数为22.60mL.
(4)根据下列数据,请计算待测盐酸的浓度:0.2000mol•L-1.
| 滴定次数 | 待测体积(mL) | 标准烧碱溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.00 |
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液.
19.下列不属于自发进行的变化是( )
| A. | 红墨水加到清水使整杯水变红 | B. | 冰在室温下融化成水 | ||
| C. | 铁器在潮湿的空气中生锈 | D. | 电解饱和食盐水 |
6.下列关于胶体和溶液的说法正确的是( )
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在1~100 nm之间 | |
| B. | 溶液呈电中性,胶体带有电荷 | |
| C. | 溶液中分散质微粒能透过滤纸,胶体中分散质微粒不能透过滤纸 | |
| D. | 制备氢氧化铁胶体时,可以将饱和FeCl3溶液滴入沸水,然后长时间煮沸 |
3.下列同学的饮食习惯科学的是( )
| A. | 多吃肉,少吃蔬菜水果 | |
| B. | 合理摄入糖类.油脂等,注意膳食平衡 | |
| C. | 为防止变胖,炒菜时不放油 | |
| D. | 适量饮用矿泉水对身体健康有益 |
14.已知温度T时,水的离子积常数为Kw,该温度下,将浓度为a mol•L-1的一元酸HA溶液与b mol•L-1的一元碱BOH溶液等体积混合,可判断该溶液一定呈中性的依据是( )
| A. | 混合溶液的PH=7 | B. | 混合溶液中,C(H+)=$\sqrt{Kw}$mol•L-1 | ||
| C. | a=b | D. | 混合溶液中,C(H+)+C(B+)=C(OH-)+C(A-) |
 ;Y的价电子轨道表示式为
;Y的价电子轨道表示式为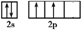 .
.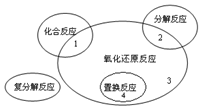 (1)氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是D
(1)氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是D