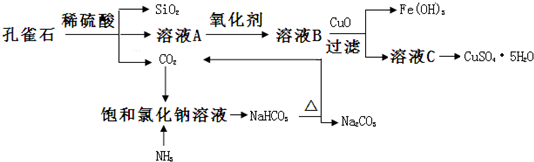
题目内容
14.98gH2SO4中(1)分子个数是6.02×1023
(2)O原子物质的量是4mol
(3)H元素的质量是2 g
(4)S原子个数是6.02×1023
(5)电子的物质的量是50 mol
(6)质子的个数是3.01×1025.
分析 结合n=$\frac{m}{M}$、N=nNA及分子构成计算.
解答 解:98gH2SO4的物质的量为$\frac{98g}{98g/mol}$=1mol,则
(1)分子个数是1mol×NA=6.02×1023个,故答案为:6.02×1023;
(2)O原子物质的量为1mol×4=4mol,故答案为:4;
(3)H元素的质量是1mol×2×1g/mol=2 g,故答案为:2;
(4)S原子个数是1mol×NA=6.02×1023个,故答案为:6.02×1023;
(5)电子的物质的量是1mol×(1×2+16+8×4)=50 mol,故答案为:50;
(6)分子中质子数=电子数,则质子的个数是50mol×NA=3.01×1025个,故答案为:3.01×1025.
点评 本题考查物质的量的计算,为高频考点,把握质量、微粒数、物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意基本计算公式的应用,题目难度不大.

练习册系列答案
相关题目
1.将铁粉和铜粉的混合物投入一定量的稀盐酸中,铁粉和铜粉仍有剩余,向反应后的溶液中缓缓地通入氯气.反应分成以下几个阶段:
回答以下问题:
(1)写出第一阶段可能发生的离子反应方程式Fe+2H+=Fe2++H2↑.
(2)第三阶段金属粉末是否有残留可能有.选填(“一定有”、“一定没有”、“可能有”)
(3)第三阶段发生的离子反应方程式是2Fe2++Cl2=2Cl-+Fe3+,2Fe3++Cu=Cu2++2Fe2+(和以上(1)中重复的不写).
(4)第四阶段金属粉末是否有残留?一定没有.选填(“一定有”、“一定没有”、“可能有”)
(5)第五阶段溶液中存在的金属阳离子是Fe3+、Fe2+、Cu2+(写出离子符号).
| 反应阶段 | 溶液中的存在的金属离子 | 残留的金属粉末 | 发生的离子反应 |
| 第一阶段 | 只有一种 | 有两种 | (1) |
| 第二阶段 | 只有一种 | 只有一种 | |
| 第三阶段 | 只有两种 | (2) | (3) |
| 笫四阶段 | 有三种 | (4) | |
| 笫五阶段 | (5) |
(1)写出第一阶段可能发生的离子反应方程式Fe+2H+=Fe2++H2↑.
(2)第三阶段金属粉末是否有残留可能有.选填(“一定有”、“一定没有”、“可能有”)
(3)第三阶段发生的离子反应方程式是2Fe2++Cl2=2Cl-+Fe3+,2Fe3++Cu=Cu2++2Fe2+(和以上(1)中重复的不写).
(4)第四阶段金属粉末是否有残留?一定没有.选填(“一定有”、“一定没有”、“可能有”)
(5)第五阶段溶液中存在的金属阳离子是Fe3+、Fe2+、Cu2+(写出离子符号).
4.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是( )
| A. | 沉淀溶解后,将会生成深蓝色的配合离子[Cu(NH3)4]2+ | |
| B. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| C. | 向反应后的溶液加入乙醇,溶液不会有变化,因为[Cu(NH3)4]2+不会与乙醇发生反应 | |
| D. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |
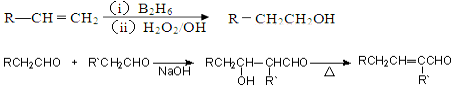
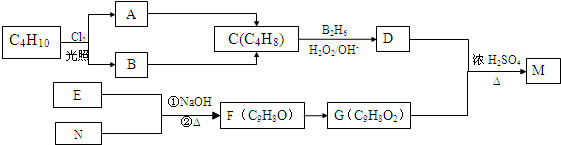
 、
、 ;
; $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$