题目内容
19.相同物质的量的14CO2与S18O2的质量之比为23:24;中子数之比为2:3;电子数之比为11:16.分析 依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$结合1个14CO2含有24个中子,22个电子,1个S18O2含有36个中子,32个电子,据此解答.
解答 解:相同物质的量的14CO2与S18O2的质量之比为:46:48=23:24,中子数之比为:24:36=2:3;电子数之比为:22:32=11:16;
故答案为:23:24;2:3;11:16.
点评 本题考查了物质的量有关计算,明确以物质的量为核心计算公式,熟悉相关物质的结构组成是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列说法正确的是( )
| A. | 22.4LN2含阿伏加德罗常数个氮分子 | |
| B. | 在标准状况下,11.2 L四氯化碳所含分子数为0.5NA | |
| C. | 22g二氧化碳与标准状况下11.2LH2含有相同的原子数 | |
| D. | 常温常压下,5.6g铁与过量的盐酸反应转移电子总数为0.2NA |
6.乙苯催化脱氢制苯乙烯反应: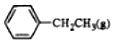 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$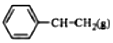 +H2O,己知:
+H2O,己知:
根据表中数据计算上述反应的△H(kJ•mol-1)( )
 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$ +H2O,己知:
+H2O,己知:| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | 612 | 436 |
| A. | -124 | B. | +124 | C. | +1172 | D. | -1048 |
7.某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
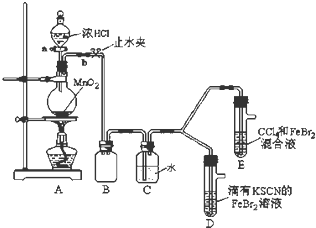
(1)①装置A中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
②整套实验装置存在一处明显的不足,请指出缺少尾气处理装置.
(2)用改正后的装置进行实验,实验过程如下:
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化.
D装置中:红色慢慢褪去.
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因过量氯气和SCN-反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,
则使Fe3++3SCN-?Fe(SCN)3平衡向逆反应方向移动而褪色,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加KSCN溶液(或FeCl3溶液)溶液,若溶液颜色变红色(或不变红),则上述解释是合理的.
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀原因BrCl+H2O=HBrO+H++Cl-、Ag++Cl-=AgCl↓.

(1)①装置A中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
②整套实验装置存在一处明显的不足,请指出缺少尾气处理装置.
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯. | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,下层CCl4层无明显变化. | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: Cl2>Br2>Fe3+ |
D装置中:红色慢慢褪去.
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
| ⅰ.Fe3++3SCN-?Fe(SCN)3 是一个可逆反应. ⅱ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应. ⅳ.AgClO、AgBrO均可溶于水. |
则使Fe3++3SCN-?Fe(SCN)3平衡向逆反应方向移动而褪色,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加KSCN溶液(或FeCl3溶液)溶液,若溶液颜色变红色(或不变红),则上述解释是合理的.
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀原因BrCl+H2O=HBrO+H++Cl-、Ag++Cl-=AgCl↓.
4.下列说法中正确的是( )
| A. | 同温同压下,气体的物质的量与体积成反比 | |
| B. | 同温同体积时,气体的物质的量与压强成反比 | |
| C. | 同温同物质的量时,气体的压强与体积成正比 | |
| D. | 同压同体积时,气体的物质的量与温度成反比 |
11.下列对氯气的叙述中正确的是( )
| A. | 能与所有金属反应 | B. | 具有氧化性 | ||
| C. | 不能支持燃烧 | D. | 具有漂白作用 |
9.下列说法正确的是( )
| A. | 标准状况下,20mL NH3跟60mL O2所含的分子个数比为1:3 | |
| B. | 22.4L O2中一定含有6.02×1023个氧分子 | |
| C. | 将80克NaOH溶于1L水中,所得溶液的物质的量浓度为2mol/L | |
| D. | 18克H2O在标准状况下的体积为0.018L |