题目内容
1.将铁粉和铜粉的混合物投入一定量的稀盐酸中,铁粉和铜粉仍有剩余,向反应后的溶液中缓缓地通入氯气.反应分成以下几个阶段:| 反应阶段 | 溶液中的存在的金属离子 | 残留的金属粉末 | 发生的离子反应 |
| 第一阶段 | 只有一种 | 有两种 | (1) |
| 第二阶段 | 只有一种 | 只有一种 | |
| 第三阶段 | 只有两种 | (2) | (3) |
| 笫四阶段 | 有三种 | (4) | |
| 笫五阶段 | (5) |
(1)写出第一阶段可能发生的离子反应方程式Fe+2H+=Fe2++H2↑.
(2)第三阶段金属粉末是否有残留可能有.选填(“一定有”、“一定没有”、“可能有”)
(3)第三阶段发生的离子反应方程式是2Fe2++Cl2=2Cl-+Fe3+,2Fe3++Cu=Cu2++2Fe2+(和以上(1)中重复的不写).
(4)第四阶段金属粉末是否有残留?一定没有.选填(“一定有”、“一定没有”、“可能有”)
(5)第五阶段溶液中存在的金属阳离子是Fe3+、Fe2+、Cu2+(写出离子符号).
分析 将铁粉和铜粉的混合物投入一定量的稀盐酸中,铁粉和铜粉仍有剩余,向反应后的溶液中缓缓地通入氯气,
第一阶段:是铁和盐酸反应生成氯化亚铁和氢气,
第二阶段:盐酸加入和剩余铁反应生成氯化亚铁和氢气,铜不反应剩余,
第三阶段:向反应后的溶液中缓缓地通入氯气,发生反应氯化亚铁和氯气反应生成氯化铁,
第四阶段:氯化铁和铜反应生成氯化亚铁和氯化铜,存在三种离子为铁离子、亚铁离子、铜离子,不存在残留物,
第五阶段:溶液中可以存在铁离子、亚铁离子、铜离子.
解答 解:将铁粉和铜粉的混合物投入一定量的稀盐酸中,铁粉和铜粉仍有剩余,向反应后的溶液中缓缓地通入氯气,
第一阶段:是铁和盐酸反应生成氯化亚铁和氢气,
第二阶段:盐酸加入和剩余铁反应生成氯化亚铁和氢气,铜不反应剩余,
第三阶段:向反应后的溶液中缓缓地通入氯气,发生反应氯化亚铁和氯气反应生成氯化铁,
第四阶段:氯化铁和铜反应生成氯化亚铁和氯化铜,存在三种离子为铁离子、亚铁离子、铜离子,不存在残留物,
第五阶段:溶液中可以存在铁离子、亚铁离子、铜离子;
(1)第一阶段溶液中的存在的金属离子只有一种为亚铁离子,残留的金属粉末为Fe、Cu,可能发生的离子反应方程式为:Fe+2H+=Fe2++H2↑,
故答案为:Fe+2H+=Fe2++H2↑;
(2)第二阶段:盐酸加入和剩余铁反应生成氯化亚铁和氢气,铜不反应剩余,溶液中的存在的金属离子为亚铁离子,残留的金属粉末为Cu,第三阶段溶液中的存在的金属离子为两种,应为通入氯气发生反应2Fe2++Cl2=2Cl-+Fe3+,2Fe3++Cu=Cu2++2Fe2+,金属粉末可能有残留,
故答案为:可能有;
(3)第三阶段溶液中的存在的金属离子为两种,应为通入氯气发生反应2Fe2++Cl2=2Cl-+Fe3+,2Fe3++Cu=Cu2++2Fe2+,
故答案为:2Fe2++Cl2=2Cl-+Fe3+,2Fe3++Cu=Cu2++2Fe2+;
(4)第四阶段:继续通入氯气氧化氯化亚铁为氯化铁,氯化铁和铜反应生成氯化亚铁和氯化铜,存在三种离子为铁离子、亚铁离子、铜离子,不存在残留物,故答案为:一定没有;
(5)第四阶段:氯化铁和铜反应生成氯化亚铁和氯化铜,存在三种离子为铁离子、亚铁离子、铜离子,不存在残留物,第五阶段溶液中存在的金属阳离子是Fe3+、Fe2+、Cu2+,
故答案为:Fe3+、Fe2+、Cu2+.
点评 本题考查金属性质、离子性质、离子氧化性强弱的反应顺序、氧化还原反应离子方程式书写,注意表中条件的分析判断,掌握基础是解题关键,题目难度中等.

①氯水放久了会逐渐由黄绿色变成几乎无色
②KI溶液中加入淀粉溶液会变成蓝色
③溴水中加入CCl4振荡静置后,CCl4层无色
④钾元素的焰色反应透过蓝色的钴玻璃观察呈紫色.
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
| A. | 实验室中进行可燃性气体燃烧性质实验时,必须先验纯,后点燃 | |
| B. | 不慎将浓碱沾到皮肤上,应立即用大量水冲洗,然后涂上硼酸溶液 | |
| C. | 配制稀硫酸时,可先在量筒中加一定体积的水,再在搅拌下慢慢加入浓硫酸 | |
| D. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
(1)已知:2NH3(g)+3Cl2 (g)=N2(g)+6HCl(g)△H=-462kJ/mol
N2(g)$\stackrel{945kJ•mol-1}{→}$2N(g)、Cl2(g)$\stackrel{243kJ•mol-1}{→}$2Cl(g)
则,断开1mol H-N键与断开1mol H-Cl键所需能量相差约为41KJ.
(2)用NH3催化还原NxOy可以消除氮氧化物的污染.如有反应4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H<0,相同条件下在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示.

①计算0~4分钟在A催化剂作用下,反应速率 υ(NO)=0.3125mol•L-1•min-1;
②下列说法正确的是CD;
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.使用催化剂A达平衡时,N2最终产率更大
C.单位时间内氢氧键与氮氢键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当平衡常数不变时,说明反应已经达到平衡
(3)用活性炭还原法的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡小组向某密闭容器中加入一定量的活性炭和NO,恒温(T1℃)调节按下反应,反应进行到不同时间测得各物质的浓度如表:
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
②若30min后,在温度不变的情况下,再向容器中充入一定量NO,平衡向正反应方向(填“正反应方向”、“逆反应方向”或“不”)移动,达新平衡时NO的体积分数等于(填“大于”、“小于”或“等于”)旧平衡时NO的体积分数
③若30min后只升温至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H<0(填“>”、“=”或“<”);从反应开始到T2℃平衡时,NO的转化率为54.5%(保留三位有效数字)
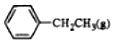 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$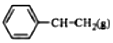 +H2O,己知:
+H2O,己知:| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | 612 | 436 |
| A. | -124 | B. | +124 | C. | +1172 | D. | -1048 |
| A. | 在一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3molH2O | |
| C. | 2,2-二甲基丙烷与Br2在光照下反应,其一溴取代物只有一种 | |
| D. | 含5个碳原子的有机物,每个分子中最多可形成4个C-C键 |
| A. | 长度 | B. | 气体摩尔体积 | C. | 摩尔 | D. | 摩尔质量 |