题目内容
2.孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物,实验室以孔雀石与食盐为原料制备CuSO4•5H2O及Na2CO3,步骤如下: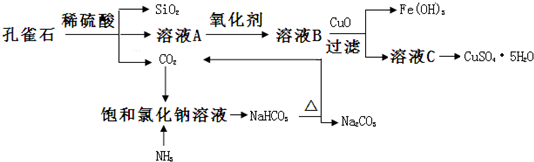
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+:从下列所给试剂中选择:
往溶液A中加入的氧化剂是c(填代号,下同),检验溶液A中Fe3+的最佳试剂为d.
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4•5H2O,需要经过加热蒸发,冷却结晶,过滤等操作除烧杯、漏斗外,过滤操作还需用到另一玻璃仪器,该仪器在此操作中的主要作用是引流.
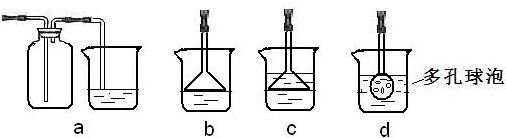
(3)制备Na2CO3时,应向NaCl饱和溶液中先通入NH3;(填NH3或CO2)若实验过程中有氨气逸出,应选用下列b装置回收(填代号).
(4)欲测定溶液A中Fe2+的浓度,需配制98mL 0.1mol∕LKMnO4标准溶液.除烧杯、玻璃棒、胶头滴管外,配制该溶液时还需的一种玻璃仪器是100mL容量瓶;配制该溶液到:往该玻璃仪器中加蒸馏水至接近刻度线1cm之后,还要进行的操作是改用胶头滴管滴加蒸馏水至溶液的凹液面正好与刻度线相平.
分析 孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物,加入稀硫酸,得到二氧化硅、二氧化碳以及A溶液,溶液A的金属离子有Cu2+、Fe2+、Fe3+,加入氧化剂将亚铁离子氧化成铁离子,溶液B含有Cu2+、Fe3+,加入CuO,可促进铁离子的水解,生成氢氧化铁沉淀,溶液C为硫酸铜溶液,蒸发、结晶可得到硫酸铜晶体,二氧化碳通入氨饱和的氯化钠溶液,可得到碳酸氢钠,加热分解生成碳酸钠,以此解答该题.
解答 解:(1)加入氧化剂将亚铁离子氧化成铁离子,所加氧化剂不能引入新杂质,可用过氧化氢,可用KSCN检验铁离子,故答案为:c;d;
(2)溶液C获得CuSO4•5H2O,需要经过加热蒸发、冷却结晶、过滤等操作,过滤时用玻璃棒引流浊液,故答案为:冷却结晶;引流;
(3)要使氯化钠溶液中生成碳酸氢钠,须在溶液显碱性的条件下通CO2,为使溶液显碱性,可向溶液中加氨水或通NH3;NH3极易溶于水,吸收多余NH3时要防止倒吸,则cd不符合,氨气密度比空气小,则不能用a装置,故答案为:NH3; b;
(4)配制98mL 0.1mol∕LKMnO4标准溶液,需要100mL容量瓶,往该玻璃仪器中加蒸馏水至接近刻度线1cm之后,还要进行的操作是改用胶头滴管滴加蒸馏水至溶液的凹液面正好与刻度线相平,防止操作不当,导致体积偏大.
故答案为:100mL容量瓶;改用胶头滴管滴加蒸馏水至溶液的凹液面正好与刻度线相平.
点评 本题考查物质制备实验方案的设计,为高频考点,把握制备实验流程中的反应及混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意除杂不能引入新杂质及防倒吸装置的选择,题目难度中等.

练习册系列答案
相关题目
9.进行化学实验必须注意安全,下列说法不正确的是( )
| A. | 实验室中进行可燃性气体燃烧性质实验时,必须先验纯,后点燃 | |
| B. | 不慎将浓碱沾到皮肤上,应立即用大量水冲洗,然后涂上硼酸溶液 | |
| C. | 配制稀硫酸时,可先在量筒中加一定体积的水,再在搅拌下慢慢加入浓硫酸 | |
| D. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
6.乙苯催化脱氢制苯乙烯反应: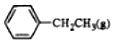 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$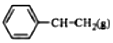 +H2O,己知:
+H2O,己知:
根据表中数据计算上述反应的△H(kJ•mol-1)( )
 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$ +H2O,己知:
+H2O,己知:| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | 612 | 436 |
| A. | -124 | B. | +124 | C. | +1172 | D. | -1048 |
13.下列对有机物结构或性质的描述错误的是( )
| A. | 在一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3molH2O | |
| C. | 2,2-二甲基丙烷与Br2在光照下反应,其一溴取代物只有一种 | |
| D. | 含5个碳原子的有机物,每个分子中最多可形成4个C-C键 |
7.某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:

(1)①装置A中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
②整套实验装置存在一处明显的不足,请指出缺少尾气处理装置.
(2)用改正后的装置进行实验,实验过程如下:
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化.
D装置中:红色慢慢褪去.
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因过量氯气和SCN-反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,
则使Fe3++3SCN-?Fe(SCN)3平衡向逆反应方向移动而褪色,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加KSCN溶液(或FeCl3溶液)溶液,若溶液颜色变红色(或不变红),则上述解释是合理的.
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀原因BrCl+H2O=HBrO+H++Cl-、Ag++Cl-=AgCl↓.

(1)①装置A中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
②整套实验装置存在一处明显的不足,请指出缺少尾气处理装置.
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯. | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,下层CCl4层无明显变化. | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: Cl2>Br2>Fe3+ |
D装置中:红色慢慢褪去.
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
| ⅰ.Fe3++3SCN-?Fe(SCN)3 是一个可逆反应. ⅱ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应. ⅳ.AgClO、AgBrO均可溶于水. |
则使Fe3++3SCN-?Fe(SCN)3平衡向逆反应方向移动而褪色,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加KSCN溶液(或FeCl3溶液)溶液,若溶液颜色变红色(或不变红),则上述解释是合理的.
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀原因BrCl+H2O=HBrO+H++Cl-、Ag++Cl-=AgCl↓.
11.下列对氯气的叙述中正确的是( )
| A. | 能与所有金属反应 | B. | 具有氧化性 | ||
| C. | 不能支持燃烧 | D. | 具有漂白作用 |
12.化学在工农业生产和日常生活中都有着重要的应用.下列说法错误的是( )
| A. | 利用催化设施,可以将汽车尾气中CO和NO转化为无害气体 | |
| B. | 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去 | |
| C. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| D. | 防止酸雨发生的重要措施之一是使用清洁能量 |