题目内容
20℃,已知2g氢气点燃后生成水放热235kJ,下列热化学方程式正确的是( )
A、H2(g)+
| ||
| B、H2(g)+O2(g)=2H2O(1)△H=-235kJ.mol-1 | ||
C、H2(g)+
| ||
| D、H2(g)+O2(g)=H2O(1)△H=-470kJ.mol-1 |
考点:热化学方程式
专题:
分析:根据热化学方程式的书写原则写出氢气燃烧生成液态水的热化学方程式,方程中的热量和化学计量数要对应,标注物质聚集状态和对应反应焓变.
解答:
解:20℃,已知2g氢气物质的量为1mol,点燃后生成水放热235kJ,反应的热化学方程式为:H2(g)+
O2(g)=H2O(1)△H=-235kJ.mol-1;
故选C.
| 1 |
| 2 |
故选C.
点评:本题考查了热化学方程式的书写方法和注意问题,掌握基础是关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、标准状况下,11.2L SO3中所含有的原子数2NA |
| B、实验室中用4mol HCl的浓盐酸跟足量MnO2 加热反应可制得的Cl2分子数为NA |
| C、25℃时,pH=13的1.0L Ba(OH)2溶液中含有OH-的数目为0.2NA |
| D、2.3g钠与一定量的氧气完全反应,转移的电子数一定为0.1NA |
下列基本实验操作正确的是( )
| A、稀释浓硫酸时,将水沿器壁缓慢注入浓硫酸中,同时不断搅拌,防止酸液溅出 |
| B、过滤时,滤纸的边缘要高于漏斗的边缘,防止液体从滤纸和漏斗壁之间流下 |
| C、胶头滴管的尖嘴部分直接伸入试管里滴加液体,避免液体溅出到试管口上 |
| D、做焰色反应实验用的铂丝用稀盐酸洗涤后,再在酒精灯火焰上灼烧到没有颜色才可使用 |

 I.某中和滴定实验过程如下:
I.某中和滴定实验过程如下: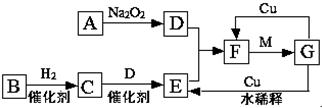 如图是由短周期元素组成的一些单质及其化合物之间的转化关系图.各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体.
如图是由短周期元素组成的一些单质及其化合物之间的转化关系图.各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体. 高锰酸钾是实验中常见的氧化剂.KMnO4溶液在中性或碱性条件下分解速度较慢,酸性条件下水溶液稳定性较差,有二氧化锰和氧气析出,见光分解速率加快.
高锰酸钾是实验中常见的氧化剂.KMnO4溶液在中性或碱性条件下分解速度较慢,酸性条件下水溶液稳定性较差,有二氧化锰和氧气析出,见光分解速率加快.