题目内容
以Mg、MgO、Mg(OH)2、MgCO3、MgSO4、BaCl2溶液和盐酸为原料,直接制取M可有多种方法,其中运用复分解反应的( )
| A、二种 | B、三种 | C、四种 | D、五种 |
考点:化学基本反应类型
专题:物质的性质和变化专题
分析:根据物质间的反应来确定化学式,此物质中肯定含有镁元素,复分解反应为化合物之间的反应,故可由氧化物、碱、盐反应生成,那么此物质是一种可溶性镁盐,根据复分解反应制取MgSO4.
解答:
解:以Mg、MgO、Mg(OH)2、MgCO3、MgSO4、BaCl2溶液和盐酸为原料,直接制取M为MgCl2
镁与盐酸反应为置换反应;氧化镁,镁盐,氢氧化镁都能与盐酸反应,且符合复分解反应特点;根据物质的性质和反应规律,则符合复分解反应的为:
①MgO+2HCl=MgCl2+H2O;
②2HCl+Mg(OH)2=MgCl2+2H2O;
③MgCO3+2HCl=MgCl2+H2O+CO2↑;
④MgSO4+BaCl2=BaSO4↓+MgCl2;
故选C.
镁与盐酸反应为置换反应;氧化镁,镁盐,氢氧化镁都能与盐酸反应,且符合复分解反应特点;根据物质的性质和反应规律,则符合复分解反应的为:
①MgO+2HCl=MgCl2+H2O;
②2HCl+Mg(OH)2=MgCl2+2H2O;
③MgCO3+2HCl=MgCl2+H2O+CO2↑;
④MgSO4+BaCl2=BaSO4↓+MgCl2;
故选C.
点评:本题考查了常见物质间的反应,完成此类题,要依据物质的性质和反应规律进行,根据题目要求适当进行猜想,然后进行验证答案的正确性.此题难度中等.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
下列说法正确的是( )
| A、含有共价键的化合物必是共价化合物 |
| B、阴、阳离子间通过静电引力所形成的化学键是离子键 |
| C、液态氯化氢中存在H+和Cl-,所以能导电 |
| D、化学变化过程,一定会破坏旧的化学键,同时形成新的化学键 |
 有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg
有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg| c(H+) |
| c(OH-) |
| A、A点时加入氢氧化钠溶液体积为20 mL |
| B、室温时0.01 mol?L-1的醋酸溶液pH=4 |
| C、OA段溶液中:c(CH3COO-)>c(CH3COOH) |
| D、若B点时加入NaOH溶液40 mL,所得溶液中:c(CH3COO-)+2 c(CH3COOH)=c(OH-)-c(H+) |
跟mg CO2中所含的氧原子数相等的KMnO4的量为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
 I.某中和滴定实验过程如下:
I.某中和滴定实验过程如下: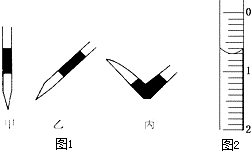 使用酸碱中和滴定法测定某未知物质的量浓度的稀盐酸.
使用酸碱中和滴定法测定某未知物质的量浓度的稀盐酸.