题目内容
短周期主族元素X、Y、Z、W、P、Q的原子序数依次增大.X 元素原子的最外层2p轨道上有2个未成对电子,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z的逐级电离能(KJ/mol)分别为:496、4562、6912;W的简单离子是同周期中离子半径最小的,P 的价电子数是其周期数的2倍.试回答下列问题:
(1)比较第一电离能:Z W(填“>”、“<”或“=”);
(2)写出Q的价电子排布图 .
(3)YF3的结构式为: ,其VSEPR模型为: .
(4)X基态原子中能量最高的电子,其原子轨道呈 形.
(5)XO2和PO2分子的立体结构分别是 和 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 .
(1)比较第一电离能:Z
(2)写出Q的价电子排布图
(3)YF3的结构式为:
(4)X基态原子中能量最高的电子,其原子轨道呈
(5)XO2和PO2分子的立体结构分别是
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:短周期主族元素X、Y、Z、W、P、Q的原子序数依次增大.Y的氟化物YF3分子中各原子均达到8电子稳定结构,则Y处于ⅤA族,结合原子序数可知,Y只能为N元素;X 元素原子的最外层2p轨道上有2个未成对电子,外围电子排布为2s22p2或2s22p4,结合原子序数可知,X只能为C元素,Z的第二电离能剧增,则Z表现+1价,可推知Z为Na;W的简单离子是同周期中离子半径最小的,则W为Al,P 的价电子数是其周期数的2倍,则P为S元素,故Q为Cl,据此解答.
解答:
解:短周期主族元素X、Y、Z、W、P、Q的原子序数依次增大.Y的氟化物YF3分子中各原子均达到8电子稳定结构,则Y处于ⅤA族,结合原子序数可知,Y只能为N元素;X 元素原子的最外层2p轨道上有2个未成对电子,外围电子排布为2s22p2或2s22p4,结合原子序数可知,X只能为C元素,Z的第二电离能剧增,则Z表现+1价,可推知Z为Na;W的简单离子是同周期中离子半径最小的,则W为Al,P 的价电子数是其周期数的2倍,则P为S元素,故Q为Cl,
(1)同周期自左而右元素第一电离能呈增大趋势,故第一电离能:Na<Al,故答案为:<;
(2)Q为Cl,其价电子排布图为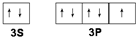 ,故答案为:
,故答案为: ;
;
(3)NF3的结构式为: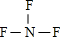 ,N原子价层电子对数=3+
,N原子价层电子对数=3+
=4,其VSEPR模型为:四面体,故答案为: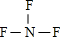 ;四面体;
;四面体;
(4)C元素基态原子中能量最高的电子为2p能级电子,其原子轨道呈纺锤形或哑铃形,故答案为:纺锤或哑铃;
(5)CO2为直线型结构,SO2分子中S原子孤电子对数=
=1,价层电子对数=1+2=3,为V形,因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大,
故答案为:直线型;V形;SO2;因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大.
(1)同周期自左而右元素第一电离能呈增大趋势,故第一电离能:Na<Al,故答案为:<;
(2)Q为Cl,其价电子排布图为
 ,故答案为:
,故答案为: ;
;(3)NF3的结构式为:
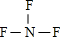 ,N原子价层电子对数=3+
,N原子价层电子对数=3+| 5-1×3 |
| 2 |
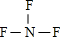 ;四面体;
;四面体;(4)C元素基态原子中能量最高的电子为2p能级电子,其原子轨道呈纺锤形或哑铃形,故答案为:纺锤或哑铃;
(5)CO2为直线型结构,SO2分子中S原子孤电子对数=
| 6-2×2 |
| 2 |
故答案为:直线型;V形;SO2;因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大.
点评:本题是对物质结构的考查,涉及电离能、核外电子排布、分子结构与性质、价层电子对互斥理论等,需要学生具备扎实的基础,难度中等.

练习册系列答案
相关题目


 实验室欲配制0.1mol/L NaOH溶液并进行有关性质实验,请据此回答下列问题
实验室欲配制0.1mol/L NaOH溶液并进行有关性质实验,请据此回答下列问题 下面是用10mol/L的浓H2SO4配制成浓度为0.1mol/L的 500mL稀H2SO4的操作,请按要求填空:
下面是用10mol/L的浓H2SO4配制成浓度为0.1mol/L的 500mL稀H2SO4的操作,请按要求填空: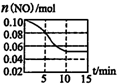 汽车尾气中含有NO和CO等有害气体.选择适当的催化剂可将CO、NO转化为无毒气体.
汽车尾气中含有NO和CO等有害气体.选择适当的催化剂可将CO、NO转化为无毒气体.