题目内容
(1)某烷烃A与炔烃B的混和气体1mol的质量为24g,取标况下的此混和气6.72L通入足量溴水中,结果溴水质量增加4g,由此可知A分子式为 ,B的结构简式为 .
(2)A、B都是芳香族化合物,1molA水解得到1molB和1mol醋酸,A、B的分子量都不超过200,完全燃烧都只生成CO2和H2O.且B分子中C、H元素总的质量分数为0.652.A溶液具有酸性,不能使FeCl3溶液显色.
①A、B的分子量之差为: ;②1个B分子中应该有 个氧原子;
③A的分子式是: ④B的同分异构体C含有酚羟基和醛基的可能结构有 种.
(2)A、B都是芳香族化合物,1molA水解得到1molB和1mol醋酸,A、B的分子量都不超过200,完全燃烧都只生成CO2和H2O.且B分子中C、H元素总的质量分数为0.652.A溶液具有酸性,不能使FeCl3溶液显色.
①A、B的分子量之差为:
③A的分子式是:
考点:有关有机物分子式确定的计算
专题:有机物分子组成通式的应用规律
分析:(1)混合气体的平均相对分子质量为24,炔烃中乙炔的相对分子质量最小为26,故烷烃A为甲烷,通入溴水增重为炔烃的质量,计算混合气体的物质的量,根据平均摩尔质量计算出混合气体的质量,然后计算出甲烷的质量、物质的量,从而得出炔烃的物质的量,然后计算出炔烃的摩尔质量,确定B可能的结构简式;
(2)①根据“1molA水解得到1molB和1mol醋酸”可表示为“A+H2O→B+CH3COOH”,运用质量守恒解答;
②A溶液具有酸性,不能使FeCl3溶液显色,则A含有-COOH,A水解得到B与醋酸,则B分子中至少含有1个-OH、1个-COOH,结合相对分子质量可知,B相对分子质量不超过158,根据B中氧元素质量分数计算分子中O原子最大数目,结合含有的官能团确定O原子数目;
③根据B中氧原子数目及氧元素质量分数确定B的相对分子质量,利用残余法确定B的分子式,结合转化关系确定A的分子式;
④结合B的分子式及C中含有的官能团确定符合条件的同分异构体.
(2)①根据“1molA水解得到1molB和1mol醋酸”可表示为“A+H2O→B+CH3COOH”,运用质量守恒解答;
②A溶液具有酸性,不能使FeCl3溶液显色,则A含有-COOH,A水解得到B与醋酸,则B分子中至少含有1个-OH、1个-COOH,结合相对分子质量可知,B相对分子质量不超过158,根据B中氧元素质量分数计算分子中O原子最大数目,结合含有的官能团确定O原子数目;
③根据B中氧原子数目及氧元素质量分数确定B的相对分子质量,利用残余法确定B的分子式,结合转化关系确定A的分子式;
④结合B的分子式及C中含有的官能团确定符合条件的同分异构体.
解答:
解:某烷烃A和炔烃B的混合气体物质的量为1mol,质量为24g,则混合气体的平均摩尔质量为:
=24g/mol,炔烃中相对分子量最小的为乙炔,其相对分子量为26,所以混合烃中一定含有甲烷,故A为CH4;
标况下6.72L混合气体的物质的量为:
=0.3mol,0.3mol混合气体的质量为:24g/mol×0.3g=7.2g,溴水质量增加4g为炔烃的质量,则甲烷的质量为:7.2g-4g=3.2g,
混合气体中甲烷的物质的量为:
=0.2mol,则炔烃B的物质的量为:0.3mol-0.2mol=0.1mol,
炔烃B的摩尔质量为:
=40g/mol,炔烃B的相对分子量为56,设炔烃B的分子式为CnH2n-2,则14n-2=40,解得n=3,故B的分子式为:C3H4,结构简式为CH≡CCH3,
故答案为:CH4;CH≡CCH3;
(2)①因“1molA水解得到1molB和1mol醋酸”可表示为“A+H2O→B+CH3COOH”,由质量守恒知:M(A)+18=M(B)+60,得M(A)-M(B)=42,故答案为:42;
②A溶液具有酸性,不能使FeCl3溶液显色,则A含有-COOH,A水解得到B与醋酸,则B分子中至少含有1个-OH、1个-COOH,结合相对分子质量可知,B相对分子质量不超过200-42=158,B中氧元素质量分数=1-0.652=0.348,则B分子中O原子最大数目=
=3.4,故有机物B分子中含有1个-COOH、1个-OH,含有O原子数目为3,故答案为:3;
③有机物B的相对分子质量=
=138,B分子是去掉1个-COOH、-OH属于基团的式量=138-45-17=76,则属于基团中C原子最大数目=
=6…4,故为-C6H4-,B的分子式为C7H6O3,则B的结构简式为 等(有邻、间、对),根据原子守恒可知,化合物A分子式为C9H8O4,
等(有邻、间、对),根据原子守恒可知,化合物A分子式为C9H8O4,
故答案为:C9H8O4;
④B的同分异构体C含有酚羟基和醛基,则C含有2个-OH、1个-CHO,若2个-OH处于邻位,-CHO有2种位置,若2个-OH处于间位,-CHO有3种位置,若2个-OH处于对位,-CHO有1种位置,故符合条件的C的结构有2+3+1=6种,
故答案为:6.
| 24g |
| 1mol |
标况下6.72L混合气体的物质的量为:
| 6.72L |
| 22.4L/mol |
混合气体中甲烷的物质的量为:
| 3.2g |
| 16g/mol |
炔烃B的摩尔质量为:
| 4g |
| 0.1mol |
故答案为:CH4;CH≡CCH3;
(2)①因“1molA水解得到1molB和1mol醋酸”可表示为“A+H2O→B+CH3COOH”,由质量守恒知:M(A)+18=M(B)+60,得M(A)-M(B)=42,故答案为:42;
②A溶液具有酸性,不能使FeCl3溶液显色,则A含有-COOH,A水解得到B与醋酸,则B分子中至少含有1个-OH、1个-COOH,结合相对分子质量可知,B相对分子质量不超过200-42=158,B中氧元素质量分数=1-0.652=0.348,则B分子中O原子最大数目=
| 158×0.348 |
| 16 |
③有机物B的相对分子质量=
| 3×16 |
| 0.348 |
| 76 |
| 12 |
 等(有邻、间、对),根据原子守恒可知,化合物A分子式为C9H8O4,
等(有邻、间、对),根据原子守恒可知,化合物A分子式为C9H8O4,故答案为:C9H8O4;
④B的同分异构体C含有酚羟基和醛基,则C含有2个-OH、1个-CHO,若2个-OH处于邻位,-CHO有2种位置,若2个-OH处于间位,-CHO有3种位置,若2个-OH处于对位,-CHO有1种位置,故符合条件的C的结构有2+3+1=6种,
故答案为:6.
点评:本题主要考查有机物分子式的确定、有机物的推断、限制条件同分异构体书写,难度中等,(2)中注意根据性质判断可能含有的官能团,确定B分子中O原子数目是关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
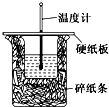 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: