题目内容
12.回答下列问题:Ⅰ.有下列四种溶液:
①100mL 0.1mol•L-1H2SO4溶液
②100mL 0.15mol•L-1 HCl溶液
③100mL 0.2mol•L-1 CH3COOH溶液
④200mL 0.1mol•L-1 CH3COOH溶液
(1)pH最小的是①(填序号,下同);由水电离的H+浓度最大的是④;与足量的Zn反应,生成H2最少的是②;
(2)①和③分别与100mL 0.2mol•L-1NaOH溶液反应,放出热量少的是③.
Ⅱ.将0.2mol•L-1 HA溶液与0.2mol•L-1NaOH溶液等体积混合后,溶液中存在c(Na+)>c(A-)
则:
(3)混合溶液中c(HA)<c(A-)(填“>”、“<”或“=”,下同);
(4)混合溶液中c(HA)+c(A-)=0.1mol•L-1;
(5)混合后由水电离出的c(OH-)>0.2mol•L-1 HA溶液由水电离出的c(H+).电离出的c(H+).
分析 I.(1)氢离子浓度越大,溶液的pH越小,弱电解质部分电离,强电解质完全电离,弱电解质的浓度越大,氢离子浓度越大,据此pH溶液pH大小;酸溶液中,氢离子浓度越大,水的电离程度越小,水电离出的c(H+)最大,则酸溶液中氢离子浓度最小;锌足量,生成氢气的量取决于溶质中含有的氢离子的总物质的量;
(2)醋酸为弱酸,电离时会吸热;
II.将0.2mol/L HA溶液与0.2mol/L NaOH溶液等体积混合,反应后溶质为NaA,A-在溶液中水解生成HA,溶液呈碱性,
(1)强碱弱酸盐的水解程度较小;
(2)依据溶液中物料守恒计算得到;
(3)酸抑制了水的电离,能够水解的盐溶液促进了水的电离.
解答 解:I.(1)①100mL 0.1mol•L-1H2SO4溶液中氢离子浓度为0.2mol/L;
②100mL 0.15mol•L-1盐酸中氢离子浓度为0.15mol/L;
③100mL 0.2mol•L-1的醋酸中,醋酸部分电离,则氢离子浓度小于0.2mol/L;
④200mL 0.1mol•L-1的醋酸中氢离子浓度小于0.1mol/L;
根据分析可知,各溶液中氢离子浓度最大的为①,则溶液的pH最小的为①;
四种溶液中,氢离子浓度最小的为④,则④对水的电离的抑制程度最小,其溶液中水电离的氢离子浓度最大;
①100mL 0.1mol•L-1H2SO4溶液中能够提供的氢离子的总物质的量为:0.1mol/L×2×0.1L=0.02mol;
②100mL 0.15mol•L-1盐酸中能够提供的氢离子的物质的量为:0.15mol×0.1L=0.015mol;
③100mL 0.2mol•L-1的醋酸中最多能够提供氢离子:0.2mol/L×0.1L=0.02mol;
④200mL 0.1mol•L-1的醋酸中能够提供的氢离子的物质的量为:0.1mol/L×0.1L=0.02mol;
根据分析可知,能够提供氢离子的物质的量最小的为②,则与足量锌反应生成氢气最少的为②,
故答案为:①;④;②;
(2)醋酸为弱酸,电离时会吸热,所以①和③分别与100mL 0.2mol•L-1NaOH溶液反应,放出热量少的是③;
故答案为:③;
II.(1)将0.2mol/L HA溶液与0.2mol/L NaOH溶液等体积混合,反应后溶质为NaA,A-在溶液中水解生成HA,溶液呈碱性,强碱弱酸盐的水解程度较小,则c(HA)<c(A-);
故答案为:<;
(2)两种溶液等体积混合,A元素的浓度变为原来的一半,根据溶液中的物料守恒得:c(HA)+c(A-)=0.1mol/L,
故答案为:=;
(3)酸或碱抑制水电离,含有弱根离子的盐促进水电离,所以混合溶液中,由水电离出来的c(OH-)>0.2mol/L HA溶液中由水电离出的c(H+),
故答案为:>.
点评 本题考查了弱电解质的电离、酸碱混合溶液定性判断,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握盐的水解原理、电荷守恒等知识在判断离子浓度大小中的应用方法.

| A. | NH4+、Ba2+、Br-、CO32- | B. | K+、Na+、SO42-、MnO4- | ||
| C. | Cl-、SCN-、Fe3+、H+ | D. | Na+、H+、NO3-、HCO3- |
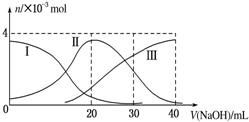
| A. | H2A在水中的电离方程式是:H2A═H++HA-;HA-?H++A2- | |
| B. | 当V(NaOH)=20mL时,溶液中各离子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 | |
| D. | 当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-) |
| 选项 | A | B | C | D |
| n(CO2)(mol) | 2 | 3 | 4 | 6 |
| n(沉淀)(mol) | 2 | 2 | 3 | 3 |
| A. | A | B. | B | C. | C | D. | D |
| A. | c(K+)>c(CN-) | B. | c(CN-)>c(HCN) | ||
| C. | c(HCN)+c(CN-)=0.2mol•L-1 | D. | c(K+)+c(H+)=c(CN-)+c(OH-) |
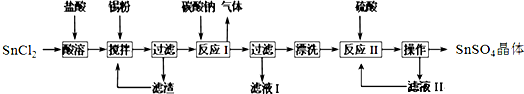
 碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.
碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.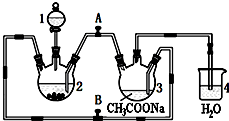 醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂.实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如右图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:
醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂.实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如右图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下: