题目内容
7.已知H2SO4(aq)与Ba(OH)2(aq)反应的△H=-1584.2kJ•mol-1;HCl(aq)与NaOH(aq)的△H=-55.6kJ•mol-1.则生成BaSO4(s)的反应热等于( )| A. | -1 528.6kJ•mol-1 | B. | -1 473kJ•mol-1 | ||
| C. | +1 473 kJ•mol-1 | D. | +1 528.6 kJ•mol-1 |
分析 ①2H+(aq)+2OH-(aq)+Ba2+(aq)+SO42-(aq)═BaSO4(s)+2H2O(l)△H=-1584.2kJ•mol-1
②H+(aq)+OH-(aq)═H2O(l)△H1=-55.6kJ•mol-1
由盖斯定律可知,①-②×2得到Ba2+(aq)+SO42-(aq)═BaSO4(s),以此来解答.
解答 解:由①2H+(aq)+2OH-(aq)+Ba2+(aq)+SO42-(aq)═BaSO4(s)+2H2O(l)△H=-1584.2kJ•mol-1
②H+(aq)+OH-(aq)═H2O(l)△H1=-55.6kJ•mol-1
由盖斯定律可知,①-②×2得到Ba2+(aq)+SO42-(aq)═BaSO4(s),则△H=-1584.2kJ•mol-1-2×(-55.6kJ•mol-1)=-1473 kJ•mol-1,
故选B.
点评 本题考查反应热与焓变,为高频考点,把握反应的关系、焓变的计算为解答的关键,侧重分析与计算能力的考查,注意盖斯定律的应用,题目难度不大.

练习册系列答案
相关题目
15.下列认识中,正确的是( )
| A. | 将一种气体通入品红溶液,溶液褪色,说明该气体一定是二氧化硫 | |
| B. | K+、NH4+、SO42-、CO32-离子组在加入铝粉能放出大量H2的溶液中一能能大量共存 | |
| C. | FeBr2溶液中通入过量Cl2时的离子方程式为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| D. | 在纯碱溶液中逐滴加入稀盐酸时,开始没有气泡产生 |
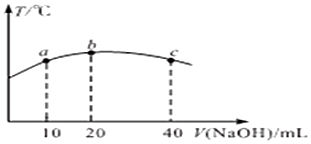
12.医药中间体化合物X的结构简式如图所示.下列有关化合物X的说法正确的是( )

| A. | X的分子式为C16H11O4 | |
| B. | X分子中有三种不同的官能团 | |
| C. | 1 mol化合物X最多能与3 mol NaOH反应 | |
| D. | X分子中两个苯环一定处于同一平面 |
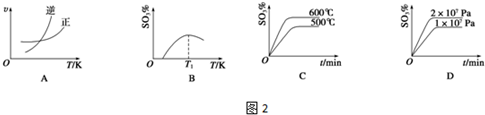
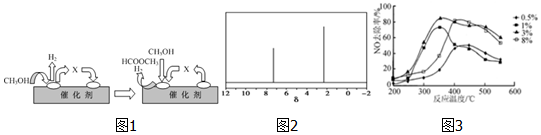
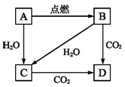 如图所示A是固体金属单质,燃烧时火焰呈黄色.
如图所示A是固体金属单质,燃烧时火焰呈黄色. CH3OH.
CH3OH. .
.