题目内容
19.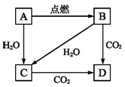 如图所示A是固体金属单质,燃烧时火焰呈黄色.
如图所示A是固体金属单质,燃烧时火焰呈黄色.(1)写出下列转化的化学方程式
A→B2Na+2H2O=2NaOH+H2↑;
B→C:2Na2O2+2H2O=4NaOH+O2↑.
(2)在上述物质转化关系图中的化学反应里,没有元素化合价变化的是C→D(用“A→B”这样的形式表示).
分析 如图所示A是固体金属单质,燃烧时火焰呈黄色判断为Na,B为Na2O2,C为NaOH,D为Na2CO3,
(1)A→B的反应为钠点燃反应生成过氧化钠;
B→C的反应为过氧化钠和水反应生成氢氧化钠和氧气;
(2)没有元素化合价变化的是二氧化碳和氢氧化钠溶液的反应.
解答 解:如图所示A是固体金属单质,燃烧时火焰呈黄色判断为Na,B为Na2O2,C为NaOH,D为Na2CO3,
(1)A→B的反应为钠点燃反应生成过氧化钠,反应的化学方程式为:2Na+2H2O=2NaOH+H2↑,
B→C的反应为过氧化钠和水反应生成氢氧化钠和氧气,反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na+2H2O=2NaOH+H2↑;:2Na2O2+2H2O=4NaOH+O2↑;
(2)没有元素化合价变化的是二氧化碳和氢氧化钠溶液的反应,是C→D,
故答案为:C→D.
点评 本题考查了无机物性质、物质转化关系、主要是钠及其化合物性质的分析判断,掌握基础是解题关键,题目难度不大.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案
相关题目
6.W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,下列说法不正确的是( )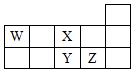

| A. | Z、Y、X的原子半径依次减小,非金属性依次降低 | |
| B. | Z、Y、W的最高价氧化物对应水化物的酸性依次降低 | |
| C. | WH4与Z元素的单质在一定条件下可能发生化学反应 | |
| D. | W的位置是第2周期、第ⅣA族 |
10.下列有关实验操作、现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液 | 有白色沉淀生成 | 溶液中不一定含有SO42- |
| B | 向装有Fe(NO3)2溶液试管中加入稀H2SO4 | 在管口观察到红棕色气体 | HNO3分解成了NO2 |
| C | 向CH3CH2X中加入少量AgNO3溶液,加热 | 有浅黄色沉淀生成 | CH3CH2X中含有Be+ |
| D | 向淀粉溶液中加入稀H2SO4加热几分钟,冷却后再加入新制Cu(OH)2溶液,加热 | 没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
7.已知H2SO4(aq)与Ba(OH)2(aq)反应的△H=-1584.2kJ•mol-1;HCl(aq)与NaOH(aq)的△H=-55.6kJ•mol-1.则生成BaSO4(s)的反应热等于( )
| A. | -1 528.6kJ•mol-1 | B. | -1 473kJ•mol-1 | ||
| C. | +1 473 kJ•mol-1 | D. | +1 528.6 kJ•mol-1 |
4.在含有大量H+、Cl-、Fe3+的溶液中,还能大量存在的离子是( )
| A. | OH- | B. | Ag+ | C. | Al3+ | D. | SCN- |
11.电离平衡常数是衡量弱电解质电离程度的物理量.已知:
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三溶液的pH由大到小的顺序为Na2CO3>NaCN>CH3COONa(用化学式表示).
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3.
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3.
8.配制一定物质的量浓度的NaOH溶液时,造成实验结果偏低的原因可能是( )
| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 称量药品时间过长 | |
| C. | 定容时俯视液面 | |
| D. | 洗涤烧杯和玻棒的溶液转入容量瓶中 |