题目内容
17.数十年来,化学工作者对碳的氧化物和氢化物做了广泛深入的研究并取得了一些重要成果.已知:C(s)+O2(g)=CO2(g);△H=-393kJ•mol-1
2CO (g)+O2(g)=2CO2(g);△H=-566kJ•mol-1
2H2(g)+O2(g)=2H2O(g);△H=-484kJ•mol-1
(1)工业上常采用将水蒸气喷到灼热的炭层上实现煤的气化(制得CO、H2),该反应的热化学方程式是C(s)+H2O(g)═CO (g)+H2(g)△H=+132 kJ•mol-1.
(2)上述煤气化过程中需向炭层交替喷入空气和水蒸气,喷入空气的目的是让部分炭燃烧,提供炭与水蒸气反应所需要的热量;该气化气可在加热和催化剂下合成液体燃料甲醇,该反应方程式为CO+2H2
 CH3OH.
CH3OH.(3)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到.
第一步:2CH3OH(g)═HCOOCH3(g)+2H2(g)△H>0
第二步:HCOOCH3(g)═CH3OH(g)+CO(g)△H>0
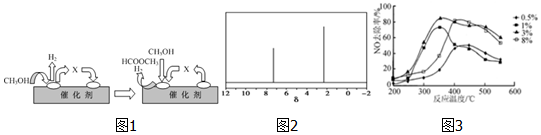
①第一步反应的机理可以用图1表示:图中中间产物X的结构简式为HCHO.
②以甲醇制一氧化碳的反应为吸热反应(填“吸热”、“放热”).
(4)天然气可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X.由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图2,则X的结构简式为
 .
.(5)C2H4可用于烟气脱硝.为研究温度、催化剂中Cu2+负载量对其NO去除率的影响,控制其他条件一定,实验结果如3图所示.为达到最高的NO去除率,应选择的反应温度和Cu2+负载量分别是350℃左右、3%.
分析 (1)水蒸气喷到灼热的炭层上实现煤的气化(制得CO、H2)即反应方程式为C(s)+H2O(g)=CO (g)+H2(g),再根据盖斯定律进行计算;
(2)根据(1)煤和水蒸气的反应生成一氧化碳和氢气要吸热,故喷入空气的目的是让部分炭燃烧,提供炭与水蒸气反应所需要的热量;一氧化碳和氢气,在一定条件下合成甲醇,据此书写方程式;
(3)①依据分解反应过程和反应机理图示分析判断,中间产物为甲醛;
②据△H>0吸热,△H<0为放热分析;
(4)芳香烃X的相对分子质量为l06,设其分子式为CxHy,由$\frac{106}{12}$=8…10=8…10,可知分子式为C8H10,分子中含有一个苯环,为苯的同系物,核磁共振氢谱中有2个峰,可知分子中含有2种环境的H,应含有2个甲基且处于对位位置;
(5)脱硝率高,负载率低,适宜的温度;
解答 解:(1)已知:①C(s)+O2(g)=CO2(g);△H=-393kJ•mol-1
②2CO (g)+O2(g)=2CO2(g);△H=-566kJ•mol-1
③2H2(g)+O2(g)=2H2O(g);△H=-484kJ•mol-1
将(①×2-②-③)×$\frac{1}{2}$得到反应C(s)+H2O(g)=CO (g)+H2(g),则△H═(-393kJ•mol-1×2+566kJ•mol-1+484kJ•mol-1)×$\frac{1}{2}$=+132 kJ•mol-1
故答案为:C(s)+H2O(g)=CO (g)+H2(g)△H=+132 kJ•mol-1
(2)根据(1)煤和水蒸气的反应生成一氧化碳和氢气要吸热,故喷入空气的目的是让部分炭燃烧,提供炭与水蒸气反应所需要的热量,
一氧化碳和氢气在一定条件下合成甲醇的原理为:CO+2H2 CH3OH,故答案为:让部分炭燃烧,提供炭与水蒸气反应所需要的热量;CO+2H2
CH3OH,故答案为:让部分炭燃烧,提供炭与水蒸气反应所需要的热量;CO+2H2 CH3OH
CH3OH
(3)①依据图示和分解反应过程,结合原子守恒可知,甲醇去氢后得到的是甲醛,化学式为HCHO,
故答案为:HCHO
②∵第一步:2CH3OH(g)═HCOOCH3(g)+2H2(g)△H>0
第二步:HCOOCH3(g)═CH3OH(g)+CO(g)△H>0
∴第一步+第二步得:CH3OH(g)═2H2(g)+CO(g)△H>0,故反应吸热,
故答案为:吸热
(4)芳香烃X的相对分子质量为l06,设其分子式为CxHy,由$\frac{106}{12}$=8…10=8…10,可知分子式为C8H10,分子中含有一个苯环,为苯的同系物,核磁共振氢谱中有2个峰,可知分子中含有2种环境的H,应含有2个甲基且处于对位位置,则X的结构简式为 ,
,
故答案为:
(5)满足脱硝率高,负载率低,适宜的温度,由图可知,适合条件为350℃左右,3%,
故答案为:350℃左右、3%
点评 本题主要考查了盖斯定律的应用、电极方程式及其化学方程式的书写、根据图象对平衡移动的判断等,重在培养学生能够利用化学知识提取题干的信息进行答题的能力,综合性强,难度较大.

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案| A. | -1 528.6kJ•mol-1 | B. | -1 473kJ•mol-1 | ||
| C. | +1 473 kJ•mol-1 | D. | +1 528.6 kJ•mol-1 |
| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 称量药品时间过长 | |
| C. | 定容时俯视液面 | |
| D. | 洗涤烧杯和玻棒的溶液转入容量瓶中 |
| A. | Z位于周期表第三周期第ⅦA族 | |
| B. | 简单离子半径由大到小排序:Z、T、X、Y | |
| C. | X、Y、Z的最高价氧化物对应的水化物能相互反应 | |
| D. | R2T2和X2T2中所含化学键类型完全相同 |
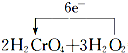 =2Cr(OH)3↓+3O2↑+2H2O
=2Cr(OH)3↓+3O2↑+2H2O 表中表示的一些物质或概念间的从属关系中不正确的是( )
表中表示的一些物质或概念间的从属关系中不正确的是( )