题目内容
今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-,现取两份200mL溶液进行如下实验:
①第一份加足量NaOH溶液,加热,收集到气体1.792L(已换算成标准状况,且设气体全部逸出);
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.
据上述实验,以下推测正确是( )
①第一份加足量NaOH溶液,加热,收集到气体1.792L(已换算成标准状况,且设气体全部逸出);
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.
据上述实验,以下推测正确是( )
| A、一定不存在Ba2+,NH4+可能存在 |
| B、CO32- 一定存在 |
| C、Na+一定不存在 |
| D、一定不存在Cl- |
考点:物质的检验和鉴别的实验方案设计
专题:物质检验鉴别题
分析:①第一份加足量NaOH溶液,加热,收集到气体1.792L,气体为氨气,其物质的量为
=0.08mol,即原溶液中存在0.08molNH4+;
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g,4.66g为硫酸钡,其物质的量为
=0.02mol,则原溶液中存在0.02molSO42-,碳酸钡的物质的量为
=0.04mol,原溶液中存在0.04molCO32-,因硫酸根离子、碳酸根离子与钡离子不能共存,一定不含Ba2+,结合电荷守恒等解答.
| 1.792L |
| 22.4L/mol |
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g,4.66g为硫酸钡,其物质的量为
| 4.66g |
| 233g/mol |
| 12.54g-4.66g |
| 197g/mol |
解答:
解:由①第一份加足量NaOH溶液,加热,收集到气体1.792L,气体为氨气,其物质的量为
=0.08mol,即原溶液中存在0.08molNH4+;
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g,4.66g为硫酸钡,其物质的量为
=0.02mol,则原溶液中存在0.02molSO42-,碳酸钡的物质的量为
=0.04mol,原溶液中存在0.04molCO32-,因硫酸根离子、碳酸根离子与钡离子不能共存,一定不含Ba2+,
由计算及溶液为电中性可知,阴离子电荷总数大于阳离子电荷总数,则一定存在Na+,而Cl-不能确定,
A.一定不存在Ba2+,一定存在NH4+,故A错误;
B.由上述分析可知,CO32- 一定存在,故B正确;
C.由电荷守恒可知,一定存在Na+,故C错误;
D.由上述分析可知,Cl-不能确定,故D错误;
故选B.
| 1.792L |
| 22.4L/mol |
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g,4.66g为硫酸钡,其物质的量为
| 4.66g |
| 233g/mol |
| 12.54g-4.66g |
| 197g/mol |
由计算及溶液为电中性可知,阴离子电荷总数大于阳离子电荷总数,则一定存在Na+,而Cl-不能确定,
A.一定不存在Ba2+,一定存在NH4+,故A错误;
B.由上述分析可知,CO32- 一定存在,故B正确;
C.由电荷守恒可知,一定存在Na+,故C错误;
D.由上述分析可知,Cl-不能确定,故D错误;
故选B.
点评:本题考查物质的鉴别和检验,为高频考点,把握物质之间的反应、物质的性质为解答的关键,侧重分析、计算及推断能力的考查,注意离子共存及电荷守恒的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列粒子中,电子排布式为1s22s22p63s23p6的有( )
| A、Sc3+ |
| B、Mg2+ |
| C、Cl- |
| D、Br- |
某主族元素原子的第一、二、三、四各级电离能依次为:899KJ/mol、1757KJ/mol、14840KJ/mol、18025KJ/mol,试分析该元素所在的族序数为( )
| A、IA族 | B、ⅡA族 |
| C、ⅢA族 | D、IVA族 |
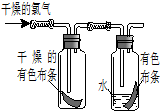 (1)如图所示,将氯气依次通过盛有干燥有色布条的和盛有潮湿有色布条的广口瓶,可观察到的现象是
(1)如图所示,将氯气依次通过盛有干燥有色布条的和盛有潮湿有色布条的广口瓶,可观察到的现象是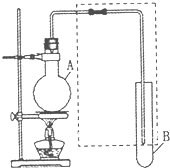 如图是用于简单有机化合物的制备、分离、性质比较等的常见简易装置.请
如图是用于简单有机化合物的制备、分离、性质比较等的常见简易装置.请