题目内容
已知1~20号元素中A、B、C、D四种元素的原子中,质子数为A<B<C<D,A元素的原子最外层电子数是次外层电子数的2倍;B元素的原子核外M层电子数是L层电子数的一半;C元素的原子次外层电子数比最外层电子数多1个.D的原子核外K层、L层电子数之和等于M、N层电子数之和,试推断:
(1)元素的名称:C ,D .
(2)原子结构示意图:A ,B .
(3)工业上由A元素的单质制取B元素的单质的化学方程式 .
(4)若没有“质子数为A<B<C<D”的限制,C还可以是 元素.
(1)元素的名称:C
(2)原子结构示意图:A
(3)工业上由A元素的单质制取B元素的单质的化学方程式
(4)若没有“质子数为A<B<C<D”的限制,C还可以是
考点:原子核外电子排布,画元素的原子结构示意图
专题:原子组成与结构专题
分析:A元素的原子最外层电子数是次外层电子数的2倍,次外层只能是K层,A为碳元素;B元素的原子核外M层电子数是L层电子数的一半,L层电子数为8,M层电子数为4,B元素为硅元素;C元素的原子次外层电子数比最外层电子数多1个,符合此条件的元素有锂和氯,因为质子数B小于C,C为氯元素;D的原子核外K层、L层电子数之和为10,又等于M、N层电子数之和,D为钙元素.根据具体元素结合题目要求解题.
解答:
解:A元素的原子最外层电子数是次外层电子数的2倍,次外层只能是K层,A为碳元素;B元素的原子核外M层电子数是L层电子数的一半,L层电子数为8,M层电子数为4,B元素为硅元素;C元素的原子次外层电子数比最外层电子数多1个,符合此条件的元素有锂和氯,因为质子数B小于C,C为氯元素;D的原子核外K层、L层电子数之和为10,又等于M、N层电子数之和,D为钙元素.
(1)由以上推断可知C为氯元素,D为钙元素,故答案为:氯;钙;
(2)A为碳元素,核外有6个电子,原子结构示意图为: ,B为硅元素,核外有14个电子,原子结构示意图为:
,B为硅元素,核外有14个电子,原子结构示意图为: ;
;
故答案为: ;
; ;
;
(3)高温条件下碳可还原二氧化硅制取硅,反应方程式为:SiO2+2C
Si+2CO↑;故答案为:SiO2+2C
Si+2CO↑;
(4)若没有若没有“质子数为A<B<C<D”的限制,C还可以是锂,因锂也满足次外层比最外层多一个电子;
故答案为:锂.
(1)由以上推断可知C为氯元素,D为钙元素,故答案为:氯;钙;
(2)A为碳元素,核外有6个电子,原子结构示意图为:
 ,B为硅元素,核外有14个电子,原子结构示意图为:
,B为硅元素,核外有14个电子,原子结构示意图为: ;
;故答案为:
 ;
; ;
;(3)高温条件下碳可还原二氧化硅制取硅,反应方程式为:SiO2+2C
| ||
| ||
(4)若没有若没有“质子数为A<B<C<D”的限制,C还可以是锂,因锂也满足次外层比最外层多一个电子;
故答案为:锂.
点评:本题考查了元素的推断,中等难度,要根据各电子层之间关系和原子结构特征结合核外电子排布规律解题.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法正确的是( )
| A、常温下,铜与氧气很难反应,因为铜和氧气的反应是吸热反应 |
| B、金属锂在常温和加热情况下与氧气反应的产物不同 |
| C、焰色反应实验中的铂丝应用稀盐酸洗涤 |
| D、用pH试纸测得某浓度氯水的pH为4 |
今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-,现取两份200mL溶液进行如下实验:
①第一份加足量NaOH溶液,加热,收集到气体1.792L(已换算成标准状况,且设气体全部逸出);
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.
据上述实验,以下推测正确是( )
①第一份加足量NaOH溶液,加热,收集到气体1.792L(已换算成标准状况,且设气体全部逸出);
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.
据上述实验,以下推测正确是( )
| A、一定不存在Ba2+,NH4+可能存在 |
| B、CO32- 一定存在 |
| C、Na+一定不存在 |
| D、一定不存在Cl- |
 1丁醇CH3CH2CH2CH2OH和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图,下列对该实验的描述错误的是( )
1丁醇CH3CH2CH2CH2OH和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图,下列对该实验的描述错误的是( )| A、不能用水浴加热 |
| B、长玻璃管起冷凝回流作用 |
| C、1-丁醇和乙酸能反应完或者有一种能消耗完 |
| D、为了提高反应速率,所以要加入浓硫酸做催化剂并加热 |

 根据如图回答问题:
根据如图回答问题: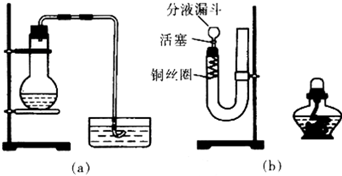

 可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)请填空:
可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)请填空: