题目内容
某主族元素原子的第一、二、三、四各级电离能依次为:899KJ/mol、1757KJ/mol、14840KJ/mol、18025KJ/mol,试分析该元素所在的族序数为( )
| A、IA族 | B、ⅡA族 |
| C、ⅢA族 | D、IVA族 |
考点:元素电离能、电负性的含义及应用
专题:元素周期律与元素周期表专题
分析:分析该元素的电离能可知,第三电离能剧增,说明该元素容易失去2个电子,则该元素原子最外层电子数为2,故在第ⅡA族.
解答:
解:分析该元素的电离能可知,第三电离能剧增,第一二电离能较小,说明该元素容易失去2个电子,则该元素原子最外层电子数为2,故在第ⅡA族.
故选B.
故选B.
点评:本题考查了电离能,根据电离能的变化推测最外层电子数,要注意根据电离能的突变分析,题目难度不大.

练习册系列答案
相关题目
今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-,现取两份200mL溶液进行如下实验:
①第一份加足量NaOH溶液,加热,收集到气体1.792L(已换算成标准状况,且设气体全部逸出);
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.
据上述实验,以下推测正确是( )
①第一份加足量NaOH溶液,加热,收集到气体1.792L(已换算成标准状况,且设气体全部逸出);
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.
据上述实验,以下推测正确是( )
| A、一定不存在Ba2+,NH4+可能存在 |
| B、CO32- 一定存在 |
| C、Na+一定不存在 |
| D、一定不存在Cl- |
自然界地表层铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下层渗透,遇到难溶的ZnS,慢慢转变为CuS.下列分析正确的是( )
| A、铜的硫化物具有氧化性 |
| B、CuS的溶解度大于ZnS的溶解度 |
| C、CuSO4与ZnS反应的离子方程式是Cu2++S2-=CuS↓ |
| D、以上过程涉及到了氧化还原反应和复分解反应 |
 如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g),反应达到平衡后,恢复到反应发生前时的温度.下列有关说法不正确的是( )
如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g),反应达到平衡后,恢复到反应发生前时的温度.下列有关说法不正确的是( )| A、根据隔板K滑动与否可判断左右两边的反应是否达到平衡 |
| B、达到平衡后,隔板K最终停留在左侧刻度0--2之间 |
| C、到达平衡时,甲容器中C的物质的量大于乙容器中C的物质的量 |
| D、若平衡时K停留在左侧1处,则活塞仍停留在右侧6处 |
X、Y为两种元素的原子,X的阴离子与Y的阳离子具有相同的电子层结构,由此可知( )
| A、X的原子半径大于Y的原子半径 |
| B、X的电负性小于Y的电负性 |
| C、X的阴离子半径大于Y的阳离子半径 |
| D、X的I1小于Y 的I1 |
 1丁醇CH3CH2CH2CH2OH和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图,下列对该实验的描述错误的是( )
1丁醇CH3CH2CH2CH2OH和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图,下列对该实验的描述错误的是( )| A、不能用水浴加热 |
| B、长玻璃管起冷凝回流作用 |
| C、1-丁醇和乙酸能反应完或者有一种能消耗完 |
| D、为了提高反应速率,所以要加入浓硫酸做催化剂并加热 |
将一定量xAl2(SO4)3?y(NH4)2SO4?24H2O晶体加入到过量NaOH溶液中,加热生成NH3 0.85g(假如生成的NH3全部逸出),再通入过量的CO2,过滤、洗涤、灼烧,得Al2O3固体2.55g.则x:y=(已知:Al2O3的相对分子质量为102;NH3的相对分子质量为17)( )
| A、1:2 | B、1:1 |
| C、1:4 | D、2:1 |
最外层为N层的基态原子中,未成对的电子数目最多为( )个.
| A、4 | B、5 | C、6 | D、7 |
某有机物其结构简式如图关于该有机物,下列叙述不正确的是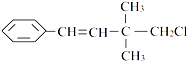 ( )
( )
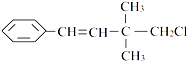 ( )
( )| A、一定条件下,能发生加聚反应 |
| B、能使溴水褪色 |
| C、一定条件下,能发生取代反应 |
| D、能与NaOH的醇溶液共热发生消去反应 |