题目内容
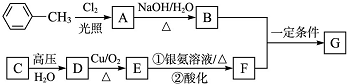
已知有4种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:Ba2+、H+、Na+、NH4+、CO32-、NO3-、OH-、SO42-,将这4种溶液分别标记为A、B、C、D并进行如下实验:
①在A或D中滴入C,均有沉淀生成;②A和B反应生成的气体能被D吸收;③A和D反应生成的气体能被B吸收.
试回答下列问题:
(1)A的化学式是 ,判断理由是 .
(2)写出其他几种物质的化学式:B 、C 、D .
(3)写出实验③中有关反应的离子方程式 .
①在A或D中滴入C,均有沉淀生成;②A和B反应生成的气体能被D吸收;③A和D反应生成的气体能被B吸收.
试回答下列问题:
(1)A的化学式是
(2)写出其他几种物质的化学式:B
(3)写出实验③中有关反应的离子方程式
考点:物质的检验和鉴别的实验方案设计,离子方程式的书写
专题:离子反应专题
分析:A和D、B都能生成气体,而题给离子中只有H+与CO32-、OH-与NH4+能反应生成气体,故A只能为(NH4)2CO3;
在A或D中滴入C,均有沉淀生成,说明D中含有SO42-,C中应含有Ba2+,
而A和D反应生成的气体说明D一定是硫酸,产生的气体是二氧化碳,能被B吸收,说明B是一种碱,
所以C是硝酸钡,B是NaOH,以此解答该题.
在A或D中滴入C,均有沉淀生成,说明D中含有SO42-,C中应含有Ba2+,
而A和D反应生成的气体说明D一定是硫酸,产生的气体是二氧化碳,能被B吸收,说明B是一种碱,
所以C是硝酸钡,B是NaOH,以此解答该题.
解答:
解:A和D、B都能生成气体,而题给离子中只有H+与CO32-、OH-与NH4+能反应生成气体,故A只能为(NH4)2CO3;在A或D中滴入C,均有沉淀生成,说明D中含有SO42-,C中应含有Ba2+,而A和D反应生成的气体说明D一定是硫酸,产生的气体是二氧化碳,能被B吸收,说明B是一种碱,所以C是硝酸钡,B是NaOH,
(1)由上述分析可知,A的化学式是(NH4)2CO3,因为:A和D、B都能生成气体,而题给离子中只有H+与CO32-、OH-与NH4+能反应生成气体,故A只能为(NH4)2CO3,故答案为:(NH4)2CO3;A和D、B都能生成气体,而题给离子中只有H+与CO32-、OH-与NH4+能反应生成气体,故A只能为(NH4)2CO3;
(2)由上述分析可知,B为NaOH,D为H2SO4,C是Ba(NO3)2,故答案为:NaOH;Ba(NO3)2;H2SO4;
(3)A和D反应的离子方程式为CO32-+2H+═CO2↑+H2O,二氧化碳可以被氢氧化钠吸收,即故答案为:CO2+2OH-=CO32-+2H2O,故答案为:CO2+2OH-=CO32-+2H2O.
(1)由上述分析可知,A的化学式是(NH4)2CO3,因为:A和D、B都能生成气体,而题给离子中只有H+与CO32-、OH-与NH4+能反应生成气体,故A只能为(NH4)2CO3,故答案为:(NH4)2CO3;A和D、B都能生成气体,而题给离子中只有H+与CO32-、OH-与NH4+能反应生成气体,故A只能为(NH4)2CO3;
(2)由上述分析可知,B为NaOH,D为H2SO4,C是Ba(NO3)2,故答案为:NaOH;Ba(NO3)2;H2SO4;
(3)A和D反应的离子方程式为CO32-+2H+═CO2↑+H2O,二氧化碳可以被氢氧化钠吸收,即故答案为:CO2+2OH-=CO32-+2H2O,故答案为:CO2+2OH-=CO32-+2H2O.
点评:本题考查离子的检验和推断,为高频考点,注意解答题目的关键是找到突破口,而本题的突破口为A和D、B都能生成气体,题目难度中等.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
下列反应中属于吸热反应的是( )
| A、活泼金属与酸反应 |
| B、Ba(OH)2?8H2O晶体与NH4Cl晶体的反应 |
| C、酸碱中和反应 |
| D、镁条燃烧 |
今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-,现取两份200mL溶液进行如下实验:
①第一份加足量NaOH溶液,加热,收集到气体1.792L(已换算成标准状况,且设气体全部逸出);
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.
据上述实验,以下推测正确是( )
①第一份加足量NaOH溶液,加热,收集到气体1.792L(已换算成标准状况,且设气体全部逸出);
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.
据上述实验,以下推测正确是( )
| A、一定不存在Ba2+,NH4+可能存在 |
| B、CO32- 一定存在 |
| C、Na+一定不存在 |
| D、一定不存在Cl- |
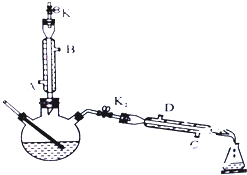 如图所示为制取乙酸乙酯的实验装置改进图,请回答下列问题
如图所示为制取乙酸乙酯的实验装置改进图,请回答下列问题