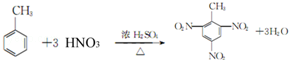
题目内容
3.25℃把 0.02mol/LCH3COOH溶液和0.01mol/LKOH溶液以等体积混和,则混合液中微粒浓度关系正确的为:(已知?25℃:CH3COOH电离常数是1.76×10-5,CH3COO-水解常数是5.78×10-10;?体积变化忽略不计;)( )| A. | c (K+)>c (CH3COO-)>c(H+)>c (OH-) | B. | c(K+)=c (CH3COO-)>c (OH-)=c (H+) | ||
| C. | c(K+)+c (H+)═c(CH3COOH)+c (OH-) | D. | c (CH3COOH)+c (CH3COO-)=0.01mol/L |
分析 0.02mol/LCH3COOH溶液和0.01mol/LKOH溶液以等体积混和后,溶液中的溶质为等物质的量浓度的CH3COOH和CH3COOK,混合溶液呈酸性,说明CH3COOH电离程度大于CH3COO-水解程度,结合电荷守恒、物料守恒判断.
解答 解:0.02mol/LCH3COOH溶液和0.01mol/LKOH溶液以等体积混和后,溶液中的溶质为等物质的量浓度的CH3COOH和CH3COOK,混合溶液呈酸性,说明CH3COOH电离程度大于CH3COO-水解程度,
A.溶液呈酸性,则c(OH-)<c(H+),溶液中存在电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(K+),则c(CH3COO-)>c(K+),所以c (CH3COO-)>c (K+)>c(H+)>c (OH-),故A错误;
B.溶液呈酸性,则c(OH-)<c(H+),溶液中存在电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(K+),则c(CH3COO-)>c(K+),故B错误;
C.溶液中存在电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(K+),溶液中c(CH3COOH)<c(CH3COO-),所以c(K+)+c (H+)>c(CH3COOH)+c (OH-),故C错误;
D.二者等体积混合后,醋酸溶液体积增大一倍,则c(CH3COOH)+c(CH3COO-)降为原来的一半,所以c(CH3COOH)+c(CH3COO-)=0.01mol/L,故D正确;
故选D.
点评 本题考查离子浓度大小比较,侧重考查学生分析判断能力,明确溶液中的溶质及其性质结合电解质溶液酸碱性判断,任何电解质溶液中都存在电荷守恒和物料守恒.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.密闭容器中有反应:Mg+2HCl=MgCl2+H2↑ 2s后HCl的浓度由2mol/L减小到1mol/L,求该反应的速率( )
| A. | 1mol/(L•s) | B. | 0.5mol/(L•s) | C. | 1.5 mol/(L•s) | D. | 无法计算 |
14.某饱和一元醇和一元醛的混合物共3g,和足量银氨溶液反应后,还原出16.2g银.下列说法正确的是( )
| A. | 该一元醇也能与银氨溶液反应生成银 | |
| B. | 混合物中一定含有甲醛 | |
| C. | 混合物中醇与醛的物质的量之比为1:3 | |
| D. | 混合物中的一元醛是乙醛 |
11.常温时,将CH3COOH溶液和NaOH溶液等体积混合后,溶液呈中性,下列各项可能正确的是( )
| A. | 混合前pH(CH3COOH)+pH(NaOH)=14 | B. | 混合后c(Na+)=c(CH3COO3-)+c(OH-) | ||
| C. | 混合前c(CH3COOH)>c(NaOH) | D. | 混合后c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
18.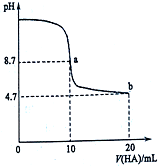 室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液pH的变化曲线如图所示.下列说法不正确的是( )
室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液pH的变化曲线如图所示.下列说法不正确的是( )
 室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液pH的变化曲线如图所示.下列说法不正确的是( )
室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液pH的变化曲线如图所示.下列说法不正确的是( )| A. | 在逐滴加入HA溶液至20mL时,NaOH溶液中水的电离程度先增大后减小 | |
| B. | b点所示溶液中c(A-)>c(HA) | |
| C. | pH=7时,c(Na+)=c(A-)+c(HA) | |
| D. | 该酸是弱酸 |
8.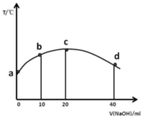 若往20ml 0.01mol/LCH3COOH溶液中逐滴加入一定浓度的烧碱溶液,测的溶液的温度变化如图所示,下列有关说法正确的是( )
若往20ml 0.01mol/LCH3COOH溶液中逐滴加入一定浓度的烧碱溶液,测的溶液的温度变化如图所示,下列有关说法正确的是( )
 若往20ml 0.01mol/LCH3COOH溶液中逐滴加入一定浓度的烧碱溶液,测的溶液的温度变化如图所示,下列有关说法正确的是( )
若往20ml 0.01mol/LCH3COOH溶液中逐滴加入一定浓度的烧碱溶液,测的溶液的温度变化如图所示,下列有关说法正确的是( )| A. | c点时,醋酸的电离程度和电离常数都最大,溶液呈中性 | |
| B. | 若b点混合溶液显酸性,则2c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| C. | 混合溶液中水的电离程度:b>c>d | |
| D. | 由图可知,该反应的中和热先增大后减小 |
15.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子通过,下列有关叙述正确的是( )
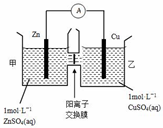

| A. | 电池工作一段时间后,乙池溶液的总质量增加 | |
| B. | 电池工作一段时间后,甲池的c(SO42-)减小 | |
| C. | 铜电极上发生氧化反应 | |
| D. | 阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |