题目内容
13.实验室有密度为1.8g/m3、质量分数为98%的“化学纯”硫酸.(1)取该浓硫酸1L加蒸馏水稀释至18L,稀释后硫酸的物质的量浓度为1mol/L
(2)现有Na2CO3、NaHCO3组成的混合物,加热到质量不再减少为止,放出标准状况下气体2.24L,取稀释后硫酸200mL恰好与剩余的残渣完全反应,又放出标准状况下气体AL,试计算
①原混合物的质量27.4g
②原混合物Na2CO3与NaHCO3物质的量之比1:2
③A=4.48L.
分析 (1)根据c=$\frac{1000ρω}{M}$计算出该浓硫酸的浓度,然后根据稀释过程中硫酸的物质的量不变计算出稀释后硫酸的浓度;
(2)①根据反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O及二氧化碳的量可计算出混合物中碳酸钠的物质的量,再根据钠离子守恒可计算出碳酸钠的物质的量,最后根据m=nM计算出混合物的总质量;
②根据①的计算可得出原混合物Na2CO3与NaHCO3物质的量之比;
③根据②可知残渣中碳酸钠的物质的量,然后根据碳原子守恒可二氧化碳的物质的量,然后根据V=nVm计算出标准状况下二氧化碳的体积.
解答 解:(1)密度为1.8g/m3、质簠分数为98%的“化学纯”硫酸的浓度为:c=$\frac{1000×1.8×98%}{98}$mol/L=18mol/L,取该浓硫酸1L加蒸馏水稀释至18L,稀释过程中硫酸的浓度不变,则稀释后硫酸的物质的量浓度为:$\frac{18mol/L×1L}{18L}$=1mol/L,
故答案为:1mol/L;
(2)①标准状况下2.24L二氧化碳的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,根据反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O可知原混合物中碳酸氢钠的物质的量为:0.1mol×2=0.2mol,
取稀释后硫酸200mL恰好与剩余的残渣完全反应,反应后溶质为硫酸钠,200mL 1mol/L的硫酸溶液中含有硫酸的物质的量为:1mol/L×0.2L=0.2mol,则反应后生成硫酸钠的物质的量为0.2mol,根据钠离子守恒可知残渣中含有碳酸钠的物质的量为0.2mol,则原混合物中含有碳酸钠的物质的量为:0.2mol-0.1mol=0.1mol,
所以原混合物的质量为:106g/mol×0.1mol+84g/mol×0.2mol=27.4g,
故答案为:27.4g;
②原混合物Na2CO3与NaHCO3物质的量之比为:0.1mol:0.2mol=1:2,
故答案为:1:2;
③残渣中含有碳酸钠的物质的量为0.2mol,根据碳原子守恒可知生成二氧化碳的物质的量为0.2mol,则生成标准状况下二氧化碳的体积为:22.4L/mol×0.2mol=4.48L,
故答案为:4.48L.
点评 本题考查了混合物反应的计算,题目难度中等,明确反应实质为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

| A. | c (K+)>c (CH3COO-)>c(H+)>c (OH-) | B. | c(K+)=c (CH3COO-)>c (OH-)=c (H+) | ||
| C. | c(K+)+c (H+)═c(CH3COOH)+c (OH-) | D. | c (CH3COOH)+c (CH3COO-)=0.01mol/L |

| A. | a的沸点最高 | B. | b的熔点最低 | ||
| C. | c的碳原子数最多 | D. | 每一种馏分都是纯净物 |
①Ca、S、Cl2、NO2②NH3•H2O、Na2CO3、CH4、KCl③H2CO3、H2SO4、NaOH、H2SiO3④MgO、SO2、CO2、SiO2从物质的基本分类看,每组中都有一种物质与其它物质不属于同这4种物质分别是( )
| A. | NO2、CH4、NaOH、MgO | B. | Cl2、NH3•H20、NaOH、Si02 | ||
| C. | Ca、Ma2C03、H2Si03、MgO | D. | NO2、CH4、H2SiO3、SO2 |
| A. | 35.7g | B. | 30g | C. | 17g | D. | 9g |
| A. | 浓盐酸 | B. | 浓硝酸 | C. | 稀盐酸 | D. | 氢氧化钠溶液 |
| A. | 若Q1+Q2<Q3,则反应为放热反应 | B. | 若Q1+Q2>Q3,则反应为放热反应 | ||
| C. | 若E1+E2>E3,则反应为吸热反应 | D. | 若E1+E2>E3,则Q1+Q2>Q3 |
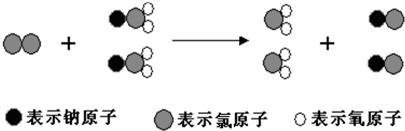
下列有关该反应的叙述中正确的是( )
| A. | 该反应的化学方程式为Cl2+2NaClO2═2ClO2+2NaCl | |
| B. | 该反应是应是复分解反应 | |
| C. | 反应中Cl2既是氧化剂,又是还原剂 | |
| D. | NaClO2和ClO2中Cl元素的化合价相同 |
 ;取代反应
;取代反应 ;加成反应
;加成反应 ;取代反应
;取代反应