题目内容
18.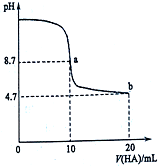 室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液pH的变化曲线如图所示.下列说法不正确的是( )
室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液pH的变化曲线如图所示.下列说法不正确的是( )| A. | 在逐滴加入HA溶液至20mL时,NaOH溶液中水的电离程度先增大后减小 | |
| B. | b点所示溶液中c(A-)>c(HA) | |
| C. | pH=7时,c(Na+)=c(A-)+c(HA) | |
| D. | 该酸是弱酸 |
分析 A.氢氧化钠溶液中加入酸HA,开始碱性减弱,水的电离程度增大,加入10mLHA时恰好反应,而后HA过量,在20mL时溶液呈酸性,抑制水的电离;
B.a点时酸碱恰好中和,溶液pH=8.7,说明HA为弱酸,b点为等浓度NaA、HA混合溶液,溶液呈酸性,说明HA的电离程度大于A-的水解程度;
C.pH=7时,溶液中c(H+)=c(OH-),结合电荷守恒判断;
D.a点时酸碱恰好中和,溶液pH=8.7,说明HA为弱酸,NaA溶液水解呈碱性.
解答 解:A.氢氧化钠溶液中加入酸HA,开始碱性减弱,水的电离程度增大,加入10mLHA时恰好反应,而后HA过量,在20mL时溶液呈酸性,抑制水的电离,在逐滴加入HA溶液至20mL时,NaOH溶液中水的电离程度先增大后减小,故A正确;
B.a点时酸碱恰好中和,溶液pH=8.7,说明HA为弱酸,b点为等浓度NaA、HA混合溶液,溶液呈酸性,说明HA的电离程度大于A-的水解程度,则:c(A-)>c(HA),故B正确;
C.pH=7时,溶液中c(H+)=c(OH-),由电荷守恒可知c(Na+)+c(H+)=c(A-)+c(OH-),则c(Na+)=c(A-),故C错误;
D.a点时酸碱恰好中和,溶液pH=8.7,说明HA为弱酸,故D正确.
故选:C.
点评 本题考查酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确各点对应溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用,试题培养了学生的灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.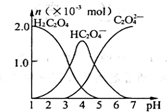 常温下,向10mL 0.2mol•L-1草酸(H2C2O4)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是
常温下,向10mL 0.2mol•L-1草酸(H2C2O4)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是
( )
 常温下,向10mL 0.2mol•L-1草酸(H2C2O4)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是
常温下,向10mL 0.2mol•L-1草酸(H2C2O4)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是( )
| A. | HC2O4-在溶液中水解程度大于电离程度 | |
| B. | 当V(NaOH)=10 mL,时,溶液中水的电离程度比纯水大 | |
| C. | 当V(NaOH)=15 mL,时,溶液中存在:c(Na+)>c(HC2O4-)>c(C2O42-)>c(OH-)>c(H+) | |
| D. | 当V(NaOH)=20 mL,时,溶液中存在:c(OH-)=c(HC2O4-)+2c(H2C2O4)+c(H+) |
3.25℃把 0.02mol/LCH3COOH溶液和0.01mol/LKOH溶液以等体积混和,则混合液中微粒浓度关系正确的为:(已知?25℃:CH3COOH电离常数是1.76×10-5,CH3COO-水解常数是5.78×10-10;?体积变化忽略不计;)( )
| A. | c (K+)>c (CH3COO-)>c(H+)>c (OH-) | B. | c(K+)=c (CH3COO-)>c (OH-)=c (H+) | ||
| C. | c(K+)+c (H+)═c(CH3COOH)+c (OH-) | D. | c (CH3COOH)+c (CH3COO-)=0.01mol/L |
10.盐酸或硫酸和氢氧化钠溶液的中和反应没有明显的现象.某学习兴趣小组的同学为了证明氢氧化钠溶液与盐酸或硫酸发生了反应,从中和反应的热效应出发,设计了下面几种实验方案.请回答有关问题.
(1)方案一:如图1装好实验装置,图中小试管用细线吊着,细线的上端拴在细铁丝上.开始时使右端U形管两端红墨水相平.实验开始,向下插细铁丝,使小试管内盐酸和广口瓶内氢氧化钠溶液混合,此时观察到的现象是U形管内液面左边下降、右边升高,原因是盐酸和氢氧化钠发生中和反应放出热量,使瓶内气体温度升高,压强增大.

(2)方案二:该小组借助反应溶液温度的变化来判断反应的发生.如果氢氧化钠溶液与盐酸混合前后有温度的变化,则证明发生了化学反应.该小组同学将不同浓度的氢氧化钠溶液和盐酸各10mL混合,用温度计测量反应前后温度的变化,测得的部分数据如下表:
则x=7.
(3)方案三:该小组还设计了如图2示装置来证明氢氧化钠溶液确实与稀硫酸发生了反应.他们认为若洗气瓶中导管口有气泡冒出,则说明该反应放出热量,从而证明发生了反应.
①实验时,打开分液漏斗活塞,发现导管流出液体不畅,原因可能是没打开分液漏斗上部塞子
②从原理上讲,该实验设计的不合理之处为稀硫酸具有一定的体积,冒出气泡的原因可能是加入稀硫酸的体积引起的.
请你在此实验装置的基础上提出修改方案分液漏斗上口和锥形瓶之间连接一导管.
(1)方案一:如图1装好实验装置,图中小试管用细线吊着,细线的上端拴在细铁丝上.开始时使右端U形管两端红墨水相平.实验开始,向下插细铁丝,使小试管内盐酸和广口瓶内氢氧化钠溶液混合,此时观察到的现象是U形管内液面左边下降、右边升高,原因是盐酸和氢氧化钠发生中和反应放出热量,使瓶内气体温度升高,压强增大.

(2)方案二:该小组借助反应溶液温度的变化来判断反应的发生.如果氢氧化钠溶液与盐酸混合前后有温度的变化,则证明发生了化学反应.该小组同学将不同浓度的氢氧化钠溶液和盐酸各10mL混合,用温度计测量反应前后温度的变化,测得的部分数据如下表:
| 编号 | 盐酸 | 氢氧化钠 | △t/℃ |
| 1 | 0.1mol•L-1 | 0.05mol•L-1 | 3.5 |
| 2 | 0.1mol•L-1 | 0.1mol•L-1 | x |
| 3 | 0.2mol•L-1 | 0.2mol•L-1 | 14 |
(3)方案三:该小组还设计了如图2示装置来证明氢氧化钠溶液确实与稀硫酸发生了反应.他们认为若洗气瓶中导管口有气泡冒出,则说明该反应放出热量,从而证明发生了反应.
①实验时,打开分液漏斗活塞,发现导管流出液体不畅,原因可能是没打开分液漏斗上部塞子
②从原理上讲,该实验设计的不合理之处为稀硫酸具有一定的体积,冒出气泡的原因可能是加入稀硫酸的体积引起的.
请你在此实验装置的基础上提出修改方案分液漏斗上口和锥形瓶之间连接一导管.
7.下列反应的离子方程式正确的是( )
| A. | 硫酸铜与烧碱溶液反应:CuSO4+2OH-═Cu(OH)2↓+SO42- | |
| B. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 碳酸钠溶液中加入足量盐酸:Na2CO3+2H+═Na++CO2↑+H2O | |
| D. | 氢氧化铝中和胃酸(盐酸):Al(OH)3+3H+═Al3++3H2O |
8.将一定质量的Mg、Fe、Al混合物与足量稀H2SO4反应,生成H211.2L(标准状况),原混合物的质量可能是( )
| A. | 35.7g | B. | 30g | C. | 17g | D. | 9g |

 .
. .
. .
. 实验室要配制2mol/L稀硫酸250mL.
实验室要配制2mol/L稀硫酸250mL.