题目内容
14.水合氧化铁(FeOOH)可用作净水剂和无机颜料等,利用硫铁矿烧渣(主要含Fe2O3、Fe3O4及杂质SiO2等)制备FeOOH工艺流程如图所示:
回答下列问题:
(1)还原焙烧时,焦炭发生的总反应可表示为:3C+2O2=2CO+CO2,焦炭的主要作用为作还原剂和提供能量;Fe3O4与CO反应转化为另一种氧化物的化学方程式为2C+Fe3O4$\frac{\underline{\;高温\;}}{\;}$3Fe+2CO2↑;
(2)酸浸时稀硫酸需过量10%并适当延长浸取时间,其目的是提高Fe的转化率;滤渣的主要成分为SiO2(填化学式);
(3)合成反应的离子方程式为Fe2++HCO3-+H2O=Fe(OH)2↓+CO2↑.
(4)第二次“过滤洗涤”时,能说明沉淀已经洗涤干净的依据是取最后一次洗涤液于试管中,加入少量盐酸酸化的氯化钡溶液,如果产生白色沉淀就说明没有洗涤干净,否则洗涤干净.
分析 硫铁矿烧渣(主要含Fe2O3、Fe3O4及杂质SiO2等)用焦炭还原焙烧,发生的反应为2C+Fe3O4$\frac{\underline{\;高温\;}}{\;}$3Fe+2CO2↑、2Fe2O3+3C$\frac{\underline{\;高温\;}}{\;}$4Fe+3CO2↑,然后用稀硫酸浸取,发生的离子反应方程式为Fe+2H+=Fe2++H2↑,过滤,得到滤渣SiO2等不溶性杂质,向滤液中加入NH4HCO3,二者发生双水解反应,反应方程式为
FeSO4+NH4HCO3+H2O=Fe(OH)2↓+CO2↑+(NH4)2SO4,
然后过滤洗涤沉淀、干燥Fe(OH)2,在空气中煅烧得到FeOOH,
(1)C具有还原性,且C燃烧能放出大量热;Fe3O4与CO发生氧化还原反应生成金属单质和二氧化碳;
(2)延长反应时间,提高酸浸效率;SiO2不溶于稀硫酸;
(3)FeSO4和NH4HCO3发生双水解反应;
(4)第二次过滤时,沉淀上易吸附SO42-,SO42-用盐酸酸化的BaCl2检验.
解答 解:硫铁矿烧渣(主要含Fe2O3、Fe3O4及杂质SiO2等)用焦炭还原焙烧,发生的反应为 2C+Fe3O4$\frac{\underline{\;高温\;}}{\;}$3Fe+2CO2↑、2Fe2O3+3C$\frac{\underline{\;高温\;}}{\;}$4Fe+3CO2↑,然后用稀硫酸浸取,发生的离子反应方程式为Fe+2H+=Fe2++H2↑,过滤,得到滤渣SiO2等不溶性杂质,向滤液中加入NH4HCO3,二者发生双水解反应,反应方程式为
FeSO4+NH4HCO3+H2O=Fe(OH)2↓+CO2↑+(NH4)2SO4,
然后过滤洗涤沉淀、干燥Fe(OH)2,在空气中煅烧得到FeOOH,
(1)C具有还原性,且C燃烧能放出大量热,所以C的作用是作还原剂且提供能量;Fe3O4与CO发生氧化还原反应生成金属单质Fe和CO2,反应方程式为2C+Fe3O4$\frac{\underline{\;高温\;}}{\;}$3Fe+2CO2↑,
故答案为:作还原剂;提供能量;2C+Fe3O4$\frac{\underline{\;高温\;}}{\;}$3Fe+2CO2↑;
(2)延长反应时间,能提高酸浸效率,从而提Fe的转化率;二氧化硅不溶于稀硫酸,所以沉淀的主要成分是SiO2,故答案为:提高Fe的转化率;SiO2;
(3)FeSO4和NH4HCO3发生复分解反应生成FeCO3和(NH4)2SO4,离子方程式为Fe2++HCO3-+H2O=Fe(OH)2↓+CO2↑,
故答案为:Fe2++HCO3-+H2O=Fe(OH)2↓+CO2↑;
(4)第二次过滤时,沉淀上易吸附SO42-,SO42-用盐酸酸化的BaCl2检验,其检验方法为:取最后一次洗涤液于试管中,加入少量盐酸酸化的氯化钡溶液,如果产生白色沉淀就说明没有洗涤干净,否则洗涤干净,故答案为:取最后一次洗涤液于试管中,加入少量盐酸酸化的氯化钡溶液,如果产生白色沉淀就说明没有洗涤干净,否则洗涤干净.
点评 本题考查物质分离和提纯,为高频考点,侧重考查学生基本操作、物质性质等知识点,涉及离子检验、双水解反应、氧化还原反应等知识点,明确实验原理及物质性质是解本题关键,易错点是(4)题,注意化学用语的灵活运用,题目难度不大.

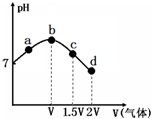 常温常压下,将NH3缓慢通入饱和食盐水中至饱和,然后向所得溶液中缓慢通入CO2,整个实验进程中溶液的pH随通入气体体积的变化曲线如图所示(实验中不考虑氨水的挥发).下列叙述不正确的是( )
常温常压下,将NH3缓慢通入饱和食盐水中至饱和,然后向所得溶液中缓慢通入CO2,整个实验进程中溶液的pH随通入气体体积的变化曲线如图所示(实验中不考虑氨水的挥发).下列叙述不正确的是( )| A. | 由a点到b点的过程中,溶液中$\frac{{c(N{H_3}•{H_2}O)}}{c(NH_4^+)}$增大 | |
| B. | 由图可知(NH4)2CO3溶液显碱性、NH4Cl溶液显酸性 | |
| C. | c点所示溶液中,c(NH4+)>c(CO32-)>c(OH-)>c(H+) | |
| D. | d点所示溶液中,c(NH4+)+c(NH3•H2O)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| A. |  根据图可判断可逆反应A2(g)+3B2(g)?2AB3(g),正反应是吸热反应 | |
| B. | 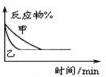 如图表示压强对反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 | |
| C. | 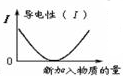 图可表示乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 | |
| D. | 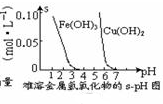 根据图可知,若除去CuSO4溶液中的Fe3+,可向溶液中加入CuO,调节pH在4~5之间即可 |
Ⅰ.在汽车尾气系统中装置催化转化器,可有效降低NOX的排放.已知:
N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)═2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:4NO2+O2+2H2O═4HNO3.
(2)尾气转化的反应之一:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.5KJ/mol.
(3)已知:N2、O2分子中化学键的键能分别是946kJ•mol-1、497kJ•mol-1,则NO分子中化学键的键能为631.5kJ•mol-1.
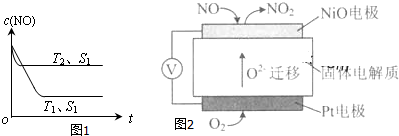
(4)当质量一定时,增大固体催化剂的表面积可提高化学反应速率.如图1表示在其他条件不变时,反应:2NO(g)+2CO(g)?2CO2(g)+N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.若催化剂的表面积S1>S2,在图1中画出c(NO) 在T1、S2条件下达到平衡过程中的变化曲线.
Ⅱ.还原法.用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2(g)+CO2(g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
(2)30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是减小CO2的浓度.
(3)若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为 5:3:3,则该反应的△H<0(填“>”、“=”或“<”).
Ⅲ.变废为宝.
(1)CO可用于合成CH3OH,反应方程式为:CO(g)+2H2(g)?CH3OH(g),在一定温度压强下(甲醇为气体),在容积为2L的密闭容器中通入0.2molCO与0.4molH2,达平衡时CO的转化率50%,再加入1.0molCO后重新达到平衡,则CO的转化率减小(填“增大”、“不变”或“减小”);
(2)通过NOx传感器可监测NOx的含量,其工作原理示意图如图2:
①Pt电极上发生的是还原反应(填“氧化”或“还原”).
②写出NiO电极的电极反应式:NO+O2--2e-=NO2.
| A. | 碘的升华、溴水中萃取溴、石油的分馏、煤的干馏均是物理变化 | |
| B. | BaSO4难溶于水是弱电解质,在医学上用作钡餐 | |
| C. | 14C可用于文物年代的鉴定,14C与12C互为同位素 | |
| D. | 明矾是常用的净水剂,可以杀菌、消毒 |
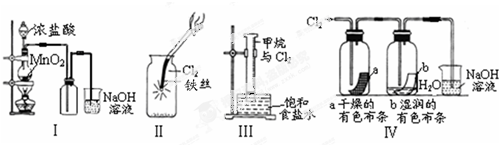
下列说法正确的是( )
| A. | Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗完 | |
| B. | Ⅱ图中:有棕黄色的雾生成 | |
| C. | Ⅲ图中:量筒中发生了加成反应 | |
| D. | Ⅳ图中湿润的有色布条能褪色,将浓硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 |
| A. | 0.9 g H2O中含有电子数为NA | |
| B. | 11.2 LCl2中含有的原子数为NA | |
| C. | 4℃、101.3kPa时,54mL H2O中含有的分子数为3NA | |
| D. | 2L 1mol/L Na2SO4溶液中离子总数为3NA |
| A. | 溴离子具有氧化性 | B. | 溴离子的还原性比氯离子弱 | ||
| C. | 该反应属于复分解反应 | D. | 氯气的氧化性比溴单质强 |
 中含有手性碳原子数2个.用“*”对应的碳原子.
中含有手性碳原子数2个.用“*”对应的碳原子.