题目内容
16.二氧化氯溶于水的反应方程式2ClO2+H2O═HClO3+HClO2,请用单线桥标明电子转移方向和数目 .
.
分析 在氧化还原反应中,化合价升高值=化合价降低值=转移电子数,据此回答判断.
解答 解:反应中,Cl从+4价升高到了+5价,从+4价降低到了+3价,电子转移为: ,故答案为:
,故答案为: .
.
点评 本题考查学生氧化还原反应中电子转移的方向和数目等知识,属于基本知识的考查,难度不大.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案
相关题目
6.下列不属于有机物的是( )
| A. |  | B. | S=C=S | C. | CCl4 | D. | HCOOH |
7.已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中A原于核外有三个未成对电子;化合物B2E为离子晶体,E原子核外的M层中只有两对成对电子;C元素的电离能数据如下表; D元素的电负性是同周期元素中最大的; F原子最外层电子数与B的相同,其余各层均充满电子.
请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
(1)B和D形成的化合物的熔点比C和D形成的化合物的熔点高(填“高”或“低”),理由是NaCl为离子晶体而AlCl3为分子晶体;冶炼C单质时加入的降低熔点的物质中含有的化学键类型有离子键、共价键、配位键(填“离子键”或“共价键”或“配位键”)
(2)E的价电子排布图为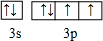 ,E的最高价氧化物对应的水化物的浓溶液与F的单质反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.
,E的最高价氧化物对应的水化物的浓溶液与F的单质反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.
(3)碳元素与E形成的化合物是极性键形成的非极性分子(填“极性”或“非极性”);其中碳原子的杂化方式为sp,该分子中含有σ键和π键的数目之比为1:1.
(4)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,则其化学式为AlN,其晶体中所含的化学键类型为共价键.
| 各级电离能 | 电离能数值kJ/mol |
| 第一电离能 | 578 |
| 第二电离能 | 1817 |
| 第三电离能 | 2745 |
| 第四电离能 | 11575 |
| 第五电离能 | 14830 |
| 第六电离能 | 18376 |
(1)B和D形成的化合物的熔点比C和D形成的化合物的熔点高(填“高”或“低”),理由是NaCl为离子晶体而AlCl3为分子晶体;冶炼C单质时加入的降低熔点的物质中含有的化学键类型有离子键、共价键、配位键(填“离子键”或“共价键”或“配位键”)
(2)E的价电子排布图为
 ,E的最高价氧化物对应的水化物的浓溶液与F的单质反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.
,E的最高价氧化物对应的水化物的浓溶液与F的单质反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.(3)碳元素与E形成的化合物是极性键形成的非极性分子(填“极性”或“非极性”);其中碳原子的杂化方式为sp,该分子中含有σ键和π键的数目之比为1:1.
(4)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,则其化学式为AlN,其晶体中所含的化学键类型为共价键.
4.下列晶体的空间构型属于直线型的是( )
| A. | H2O | B. | CO2 | C. | NH3 | D. | H2O2 |
11. 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.其中电极均为Pt电极.下列说法不正确的是( )
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.其中电极均为Pt电极.下列说法不正确的是( )
 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.其中电极均为Pt电极.下列说法不正确的是( )
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.其中电极均为Pt电极.下列说法不正确的是( )| A. | 电流由O2所在的铂电极经外电路流向另一电极 | |
| B. | O2在右侧电极发生还原反应,且该电极附近溶液的pH升高 | |
| C. | 该电池的负极反应式为:CH3CH2OH+3H2O-12e-═2CO2↑+12H+ | |
| D. | 微处理器通过检测电流大小而计算出被测气体中酒精的含量 |
 .
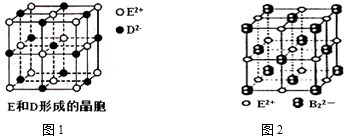
.
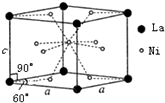 Ni和La的合金是目前使用广泛的储氢材料.该合金的晶胞结构如图所示.
Ni和La的合金是目前使用广泛的储氢材料.该合金的晶胞结构如图所示.