题目内容
4.下列晶体的空间构型属于直线型的是( )| A. | H2O | B. | CO2 | C. | NH3 | D. | H2O2 |
分析 根据价层电子对互斥理论确定,价层电子对个数=σ键个数+孤电子对个数.多原子分子若要属于直线型分子,中心原子应采取sp杂化,且无孤对电子.
解答 解:A.H2O中O原子杂化轨道数=σ键数+孤对电子对数=2+$\frac{6-2}{2}$=4,所以采取sp3杂化,分子构型为V型,故A错误;
B.二氧化碳分子中碳原子含有2个σ键且不含孤电子对,所以碳原子采用sp杂化,二氧化碳分子构型为直线型分子,故B正确;
C.NH3分子中N原子含有3个共用电子对和一个孤电子对,所以其价层电子对是4,采用sp3杂化,分子构型为三角锥型,故C错误;
D.双氧水分子是每个氧原子含有2个共用电子对且含有2个孤电子对,所以其价层电子对数是4,氧原子采用sp3杂化,形成V形结构,分子构型为为展开书页形结构,故D错误;
故选B.
点评 本题考查常见有机物的分子构型,注意题中直线型的要求,注意熟记一些常见物质的空间构型,注意孤电子对的确定以及原子杂化理论的应用为解答关键,题目难度不大.

练习册系列答案
相关题目
15.下列各组物质中,所含化学键(离子键、共价键)类型完全相同的是( )
| A. | H2O2、K2O2、C2H2 | B. | CaC12、BaO2、MgF2 | ||
| C. | CO2、CS2、KO2 | D. | NH4Cl、NaOH、KHS04 |
12.可逆反应:2NO2(g)?2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2;
②混合气体的密度不再改变的状态
③混合气体的平均相对分子质量不再改变的状态
④单位时间内生成n mol O2的同时生成2n mol NO
⑤混合气体的压强不再改变的状态.
①单位时间内生成n mol O2的同时生成2n mol NO2;
②混合气体的密度不再改变的状态
③混合气体的平均相对分子质量不再改变的状态
④单位时间内生成n mol O2的同时生成2n mol NO
⑤混合气体的压强不再改变的状态.
| A. | ①③⑤ | B. | ②③⑤ | C. | ①②④ | D. | 全部 |
19.在水中加入下列物质,可使水的电离平衡正向移动,且所得溶液呈酸性的是( )
| A. | NaCl | B. | H2SO4 | C. | Na2CO3 | D. | NH4Cl |
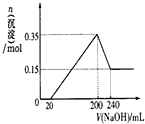 A、B、C、D均为中学化学中常见的物质,它们之间转化关系如图(部分产物已略去):A$→_{一定条件}^{+D}$B$→_{一定条件}^{+D}$C
A、B、C、D均为中学化学中常见的物质,它们之间转化关系如图(部分产物已略去):A$→_{一定条件}^{+D}$B$→_{一定条件}^{+D}$C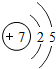 ;
; .
.